Elektrokaplama

Elektrokaplama katı bir alt tabaka üzerinde o metalin katyonlarının doğrudan bir elektrik akımı vasıtasıyla indirgenmesi yoluyla metal kaplama yapan işlemlerin genel adıdır. Kaplanacak kısım elektrolitik hücrenin katodu (negatif elektrot) görevi görür; elektrolit, kaplanacak metal tuzunun çözeltisidir; ve anot (pozitif elektrot) genellikle ya o metalin külçesi veya bazı etkisiz iletken malzemelerdir. Akım harici bir güç kaynağı tarafından sağlanır.
Elektrokaplama sanayinde ve dekoratif sanatlarda aşınma ve korozyona direnç, kayganlık, yansıtıcılık, elektriksel iletkenlik veya estetik görünüm gibi nesnelerin yüzey niteliklerini iyileştirmek için yaygın olarak kullanılır. Küçük boyutlu veya aşınmış parçalarda kalınlık oluşturmak veya elektroformlama denilen işlem karmaşık şekilli metal plakaları üretmek için de kullanılabilir. Bakır gibi metalleri saflaştırmak için de kullanılır.
"Elektrokaplama" terimi gümüş/gümüş klorür elektrotları yapmak için gümüş tel üzerinde gümüş klorür oluşumunda olduğu gibi katı bir altlık üzerinde anyonların oksidasyonunu sağlamada elektrik akımı kullanan işlemler için de bazen kullanılır.
Elektropolisaj metal bir nesnenin yüzeyinden metal katyonlarını uzaklaştırmak için elektrik akımını kullanan işlem olup elektrokaplamanın tersi olarak düşünülebilir.[1]
İşlem
[değiştir | kaynağı değiştir]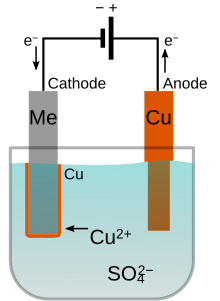
Elektrolit, kaplanacak metalin pozitif iyonlarını (katyonlarını) içermelidir. Bu katyonlar katotta sıfır değerlik durumunda metale indirgenir. Örneğin bakır kaplamaya yönelik elektrolit Cu2+ katyonlarına ve SO2-4 anyonlarına ayrışan bakır(II) sülfat çözeltisi olabilir. Katotta, Cu2+ iki elektron kazanarak metalik bakıra indirgenir.
Anot kaplama metalinden yapıldığında orada ters reaksiyon olabilir ve onu çözünmüş katyonlara dönüştürür. Örneğin bakır iki elektron kaybederek anotta Cu2+ 'ye yükseltgenir. Bu durumda anodun çözünme hızı katodun kaplandığı orana eşit olur ve bu yüzden elektrolit banyosundaki iyonlar anot tarafından sürekli olarak doldurulur. Net sonuç, metalin anot kaynağından katoda etkili transferidir.[2] Bunun yerine anot, kurşun veya karbon gibi elektrokimyasal oksitlenmeye dirençli malzemeden yapılabilir. Oksijen, hidrojen peroksit veya diğer bazı yan ürünler daha sonra anotta üretilir. Bu durumda kaplanacak metalin iyonları solüsyondan çekilirken banyoda periyodik olarak yenilenmelidir.[3]
Kaplama genellikle alaşım değil tek metalik elementtir. Ancak bazı alaşımlar özellikle pirinç ve lehim olmak üzere elektro biriktirilebilir. Kaplanmış "alaşımlar" gerçek alaşımlar yani katı çözeltiler değil daha çok kaplanan metallerin küçük kristalleridir. Kaplanmış lehim durumunda bazen "gerçek bir alaşıma" sahip olmanın gerekli olduğu varsayılır ve kaplanmış lehim, kalay ve kurşunun gerçek bir alaşım oluşturmak üzere birleşmesine izin vermek için eritilir. Gerçek alaşım kaplanmış alaşımdan daha korozyona dayanıklıdır.
Pek çok kaplama banyosunda biriktirilecek metalin siyanürlerine ek olarak diğer metallerin siyanitleri (potasyum siyanür gibi) bulunur. Bu serbest siyanürler anot korozyonunu kolaylaştırır, sabit metal iyonu seviyesinin korunmasına yardımcı olur ve iletkenliğe katkı yapar. Ayrıca iletkenliği artırmak için karbonatlar ve fosfatlar gibi metal olmayan kimyasallar da eklenebilir.
Alt tabakanın belirli bölgelerinde kaplama istenmediğinde banyonun alt tabaka ile temas etmesini önlemek için durdurucular uygulanır. Tipik durdurucular, bant, folyo, cilalar ve vakslardır.[4]
Kaplamanın düzgün şekilde örtme kabiliyetine atma gücü denir. Atma gücü ne kadar iyi olursa kaplama o kadar düzgün olur.[5]
Vuruş
[değiştir | kaynağı değiştir]Başlangıçta, yüksek kaliteli ve alt tabakaya iyi yapışan çok ince (tipik olarak 0,1 μm'den daha az kalınlıkta) bir kaplama oluşturmak için darbe veya flaş denilen özel bir kaplama birikintisi kullanılabilir. Bu, sonraki kaplama işlemleri için bir temel görevi görür. Darbede yüksek akım yoğunluğu ve düşük iyon konsantrasyonlu banyo kullanılır. İşlem yavaş olduğundan istenilen vuruş kalınlığı elde edildikten sonra daha verimli kaplama işlemleri kullanılır.
Vuruş yöntemi aynı zamanda farklı metallerin kaplanmasıyla birlikte de kullanılır. Korozyon direncini artırmak için bir metalin üzerine bir tür kaplamanın kaplanması isteniyorsa ancak bu metal doğası gereği alt tabakaya az yapışıyorsa, ilk önce her ikisiyle de uyumlu olan bir darbe uygulanabilir. Bu durumun bir örneği, elektrolitik nikelin çinko alaşımlarına zayıf tutunmasıdır ki bu durumda her ikisine de iyi tutunan bakır darbesi kullanılır.[3]
Elektrokimyasal kaplama
[değiştir | kaynağı değiştir]Elektrokimyasal çökeltme, genellikle aşağıdaki avantajlardan dolayı metallerin büyümesi ve metal oksitlerin iletilmesi için kullanılır: nanoyapının kalınlığı ve morfolojisi, elektrokimyasal parametrelerin ayarlanmasıyla hassas bir şekilde kontrol edilebilir; nispeten tekdüze ve kompakt birikintiler, şablon bazlı yapılarda sentezlenebilir; daha yüksek birikim oranları elde edilir; ve ekipman yüksek vakum veya yüksek reaksiyon sıcaklığı gibi gerekliliklerin olmaması nedeniyle ucuzdur.[6][7][8]
Darbeli elektrokaplama
[değiştir | kaynağı değiştir]Darbeli elektrokaplama veya darbeli elektrodepozisyon (PED) işlemi, elektriksel potansiyelin veya akımın iki farklı değer arasında hızlı bir şekilde değişmesini içerir. Bu, sıfır akımla ayrılmış eşit genlik, süre ve polariteli bir dizi darbeyle sonuçlanır. Darbe genliğini ve genişliğini değiştirerek, biriktirilen filmin bileşimini ve kalınlığını değiştirmek mümkündür.[9]
Darbeli elektrokaplamanın deneysel parametreleri genellikle tepe akımı/potansiyel, görev döngüsü, frekans ve etkili akım/potansiyelden oluşur. Tepe akımı/potansiyel, elektrokaplama akımının veya potansiyelinin maksimum ayarıdır. Görev döngüsü uygulanan akım veya potansiyel ile belirli bir elektrokaplama periyodunda zamanın etkili kısmıdır. Etkin akım/potansiyel, akım veya potansiyelin görev döngüsü ve tepe değeri çarpılarak hesaplanır.
Darbeli elektrokaplama, elektrolizle kaplanmış filmin kalitesini artırmaya ve hızlı biriktirme sırasında oluşan iç gerilimi serbest bırakmaya yardımcı olabilir. Kısa görev döngüsü ve yüksek frekansın birleşimi yüzey çatlaklarını azaltabilir. Ancak etkin akımı veya potansiyeli sabit tutmak için yüksek akım/potansiyel ve hızlı anahtarlama sağlayacak yüksek performanslı bir güç kaynağına ihtiyaç duyulabilir. Darbeli elektrokaplamanın diğer sorunu, özellikle platin gibi çok maliyetli, asal elektroda ters elektrokaplamada anot malzemesinin kaplanması ve kirlenebilmesidir.
Darbeli elektrokaplamayı etkileyen diğer faktörler arasında sıcaklık, anot-katot aralığı ve karıştırma vardır. Bazen, Arrhenius yasasına göre çoğu kimyasal reaksiyonun hızı sıcaklıkla birlikte üstel olarak arttığından, biriktirme oranını artırmak için ısıtılmış elektrokaplama banyosunda darbeli elektrokaplama gerçekleştirilebilir. Anot-katot boşluğu, anot ve katot arasındaki akım dağılımıyla ilgilidir. Numune alanı oranındaki küçük boşluk, akımın eşit olmayan dağılımına neden olabilir ve kaplanmış numunenin yüzey topolojisini etkileyebilir. Karıştırma, metal iyonlarının toplu çözeltiden elektrot yüzeyine transfer/difüzyon hızını artırabilir. Karıştırma ayarı farklı metal elektrokaplama işlemlerine göre değişir.
Fırçalı elektrokaplama
[değiştir | kaynağı değiştir]Yakından ilişkili bir süreç, bölgesel alanların veya tüm öğelerin kaplama çözeltisine doymuş bir fırça kullanılarak kaplandığı fırçayla elektro kaplamadır.
Genellikle hem kaplama solüsyonunu tutan hem de kaplanan ürünle doğrudan teması önleyen emici kumaş malzemeyle sarılmış paslanmaz çelik gövdeden oluşan fırça, düşük voltajlı bir doğru akım güç kaynağının anoduna ve kaplanacak öğe katoda bağlanır. Operatör, fırçayı kaplama çözeltisine batırır ve ardından kaplama malzemesinin eşit bir şekilde dağılmasını sağlamak için fırçayı sürekli hareket ettirerek ürüne uygular.
Fırçalı elektro kaplamanın tank kaplamaya göre taşınabilirlik, herhangi bir nedenden dolayı tankla kaplanamayan öğeleri kaplama yeteneği (örneğin bina restorasyonunda çok büyük dekoratif destek kolonların kaplanması), az veya hiç maskeleme gereksinim olmaması ve nispeten az kaplama solüsyon hacim gereksinimi gibi çeşitli avantajları vardır.
Tank kaplamaya kıyasla dezavantajları daha çok işçilik gerektirmesi (tank kaplaması çok az özen gerektirir) ve büyük plaka kalınlığı elde edilememesidir.
Fırçalı elektrokaplamada sert krom
[değiştir | kaynağı değiştir]Sert krom, mukavemeti, direnci ve şık kaplaması nedeniyle sert kaplama ve elektro kaplama için kullanılan en yaygın kaplama malzemelerindendir. Ancak krom altı değerlikli durumunda çok tehlikelidir. Solunduğunda veya tüketildiğinde, havadaki Cr 6+ [JT2] akciğer kanserine bağlanmıştır ve boğaz, ağız ve burunda hasara neden olur. Bunun nedeni kromun altı değerlikli durumunda kanserojen ve teratojenik özelliklere sahip olması ve hücreler üzerinde mutajenik etkiye sahip olmasıdır.
Her yıl 558.000 Amerikalı teknisyen, işyerinde altı değerlikli kroma maruz kalır ve elektrokaplama, kaynak ve boyama endüstrilerinde çalışanlar, yüksek Cr 6+ bileşenlerine maruziyetin artması nedeniyle çok risk altındadır.[10]
Altı değerlikli kromla bağlantılı tehlikeler nedeniyle daha güvenli, çevre dostu alternatifler bulmak, son on yıldır fırça elektrokaplama araştırmalarının ana itici gücü oldu. Geliştirilen bir alternatif, metal matrisli kompozitlerdir (MMC). MMC, yüksek sıcaklıklarda sertlik, aşınma direnci ve oksidasyon koruması dahil olmak üzere metal kaplama çözümlerine benzersiz ve üstün özellikler sağlar. Bu krom alternatifi MMC, kobalt krom karbür, nikel wolfram karbür ve nikel krom karbür içerir.[11]
Tamburda kaplama
[değiştir | kaynağı değiştir]Bu elektrokaplama tekniği, endüstride çok sayıda küçük nesneler için yaygın kullanılır. Nesneler fıçı şeklindeki iletken olmayan bir tambura konulur ve sonra üzerlerine kaplanacak olan metalin çözünmüş iyonlarını içeren kimyasal banyoya daldırılır. Daha sonra tambur döndürülür ve elektrik akımları, birbirlerine dokunduklarında devreleri tamamlayan tamburdaki parçalardan geçirilir. Sonuç, çok tekdüze ve verimli bir kaplama işlemidir ancak son ürünlerdeki son kat kaplama işleminde muhtemelen aşınmaya maruz kalır. Çok süslemeli veya hassas tasarımlı ürünlere uygun değildir.[12]
Temizlik
[değiştir | kaynağı değiştir]Moleküler yağ katmanları kaplamanın yapışmasını önleyebildiğinden başarılı elektrokaplama için temizlik çok önemlidir. ASTM B322 elektrokaplamadan önce metalleri temizlemek için standart bir kılavuzdur. Temizleme, solventle temizleme, sıcak alkali deterjanla temizleme, elektro temizleme ve asitle muamele vb. içerir. Temizlik için en yaygın endüstriyel test, yüzeyin iyice durulandığı ve dik tutulduğu su kırma (İngilizce: waterbreak test) testidir. Yağlar gibi hidrofobik kirleticiler, suyun damlamasına ve parçalanmasına neden olarak suyun hızlı şekilde boşalmasına neden olur. Mükemmel şekilde temizlenmiş metal yüzeyler hidrofiliktir ve boncuklanmayan veya akmayan kırılmamış bir su tabakası tutar. ASTM F22, bu testin bir versiyonunu açıklar. Bu test hidrofilik kirleticileri tespit etmez ancak elektrokaplama çözeltiler su bazlı olduğundan bunların yerini kolayca alabilir. Sabun gibi yüzey aktif maddeler testin hassasiyetini azaltır ve iyice durulanması gerekir.
Etkileri
[değiştir | kaynağı değiştir]Elektrokaplama iş parçasının kimyasal, fiziksel ve mekanik özelliklerini değiştirir. Nikel kaplamanın korozyon direncini artırması kimyasal değişime bir örnektir. Fiziksel değişikliğe bir örnek, dış görünüşteki değişikliktir. Mekanik değişikliğe bir örnek, takım endüstrisinde gerekli bir özellik olan gerilme mukavemetinde veya yüzey sertliğinde değişikliktir.[13]
Alttaki bakır veya nikel kaplı devrelerde asit altının elektrokaplaması temas direncini ve yüzey sertliğini azaltır. Bakır kaplı yumuşak çelik alanlar, bu tür alanların yüzey sertleşmesi istenmiyorsa maske görevi yapar. Kalay kaplı çelik, kalayın oksidasyonu nedeniyle yüzeyin matlaşmasını önlemek için krom kaplıdır.
Elektro kaplama veya elektriksiz kaplama, radyoaktif hipofosfit <sup id="mwpw">32</sup> P iyonları içeren nikel- fosfor konsantrelerinden hazırlanan sulu bir çözelti kullanarak metal bir parçayı radyoaktif hale getirmenin yolu olarak kullanılabilir.[14]
Elektro kaplamaya alternatifler
[değiştir | kaynağı değiştir]Elektrolitik indirgeme içermeyen katı alt tabakadaki metallerin üzerine metal kaplama yapmak için birçok alternatif süreç vardır:
- Akımsız kaplama, metal iyonları ve bunları redoks reaksiyonları ile metale indirgeyecek kimyasallar içeren bir banyo kullanır. Reaksiyon otokatalitik olmalıdır, böylece yeni metal, tüm banyoda bir defada toz olarak çökeltilmek yerine büyüyen kaplamanın üzerine çökelecektir. Elektriksiz işlemler, aşınma ve korozyon direnci için nikel-fosfor veya nikel-bor alaşımlarını, ayna yapımı için gümüşü, baskılı devre kartları için bakır ve daha fazlasını biriktirmek için yaygın olarak kullanılmaktadır. Bu işlemlerin elektro kaplamaya göre önemli bir avantajı, rastgele şekle sahip yüzeyler üzerinde, deliklerin içinde bile tekdüze kalınlıkta kaplamalar üretebilmeleri ve altlığın elektriksel olarak iletken olmasına gerek olmamasıdır. Diğer bir büyük fayda, güç kaynaklarına veya özellikle şekillendirilmiş anotlara ihtiyaç duymamalarıdır. Dezavantajlar arasında daha düşük biriktirme hızı, nispeten pahalı kimyasalların tüketimi ve sınırlı kaplama metali seçimi yer alır.
- Daldırmalı kaplama işlemleri, alt metalin çözülebilir iyonlara oksitlendiği yer değiştirme reaksiyonlarından yararlanırken, kaplama metalinin iyonları indirgenir ve yerine çökeltilir. Bu işlem çok ince kaplamalarla sınırlıdır çünkü alt tabaka tamamen kaplandıktan sonra reaksiyon durur. Yine de, baskılı devre kartlarında altın kaplamalı elektrik kontakları elde etmek için kullanılan akımsız nikel daldırma altın (ENIG) işlemi gibi bazı önemli uygulamalara sahiptir.
- Püskürtme, metalin mikroskobik parçacıklarını bir vakumda alttabakaya püskürtmek için güçlü elektron ışını kullanır.
- Fiziksel buhar biriktirme, metali buharlaştırarak alt tabakaya aktarır.
- Kimyasal buhar biriktirme, kimyasal reaksiyonun sonucu olarak altlık üzerinde biriken uçucu bir metal bileşiği içeren gaz kullanır.
- Yaldız, bir yapıştırıcıyla yerinde tutulan çok ince altın tabakası uygulayarak metaller üzerine altın tabaka oluşturmanın geleneksel yoludur.

Tarih
[değiştir | kaynağı değiştir]
İlk elektrokaplamanın Part İmparatorluğu döneminde yapılmış olması muhtemeldir. Wilhelm König, 1930'larda Irak Ulusal Müzesi 'nde asistandı. König antik Irak'tan kalan çok ince altın katmanlarla kaplanmış bir dizi çok ince gümüş objeyi gözlemlemiş ve bunların elektrolizle kaplandıklarına dair tahminler yapmıştı.[15][16] Pers'in Part (MÖ 150 - MS 223) ve Sasani (MS 224-650) imparatorluklarının başkenti Ctesiphon metropolünün yakınında 1938'de keşfedilen olası bir Part bataryası'na atıfta bulunarak fikrini destekledi. Cihazın aslında pil olup olmadığı ve öyleyse ne için kullanıldığı araştırmacılar arasında tartışma konusu olmaya devam etmektedir.[17] Ancak modern arkeologlar artık genel olarak König'in gördüğü nesnelerin aslında elektrolizle kaplanmadığı, daha ziyade cıva kullanılarak ateşle kaplandığı konusunda hemfikir. Bu nedenle, antik Mezopotamya'dan, elektrokaplama belirtileri gösterdiği güvenilir bir şekilde tanımlanabilecek bilinen hiçbir nesne örneği yoktur.[18]
Modern elektrokimya 1805'te İtalyan kimyager Luigi Valentino Brugnatelli tarafından icat edildi. Brugnatelli, meslektaşı Alessandro Volta'nın beş yıl önceki icadı volta pilini, ilk elektrokaplamayı kolaylaştırmak için kullandı. Brugnatelli'nin icatları Fransız Bilimler Akademisi tarafından örtbas edildi ve sonraki otuz yıl sanayide kullanılmadı. 1839'a gelindiğinde, İngiltere ve Rusya'daki bilim adamları baskı plakalarının bakır elektrokaplaması için Brugnatelli'ninkine benzer metal kaplama süreçlerini bağımsız olarak tasarladılar.

Rusya'daki Boris Jacobi, galvanoplastikleri yeniden keşfetmekle kalmadı aynı zamanda elektrotipleme ve galvanoplastik heykel geliştirdi. Galvanoplastikler, mucit Peter Bagration, bilim adamı Heinrich Lenz ve bilimkurgu yazarı Vladimir Odoyevsky gibi insanlarla birlikte teknolojinin daha da gelişmesine katkıda bulunan Rusya'da hızla moda oldu. Sankt-Peterburg'daki St. Isaac Katedrali‘nin devasa galvanoplastik heykelleri ve Dünya'nın en yüksek Ortodoks kilisesi Moskova'daki Kurtarıcı İsa Katedrali'nin altın kaplama kubbesi, 19. yüzyılın ortalarında Rusya'da elektrokaplama kullanımının en kötü şöhretli örneklerindendir.[19]

Kısa süre sonra İngiltere, Birmingham'dan John Wright, potasyum siyanürün altın ve gümüş elektrokaplama için uygun bir elektrolit olduğunu keşfetti. Wright'ın ortakları George Elkington ve Henry Elkington, 1840 yılında elektro kaplama için ilk patentleri aldılar. Bu ikisi daha sonra dünyaya yayıldığı Birmingham'da elektro kaplama sanayisi kurdu. Halen Thinktank, Birmingham Bilim Müzesi'nde bulunan 1844 tarihli Woolrich Elektrik Jeneratörü, endüstride kullanılan en eski elektrik jeneratörüdür.[20] Bu jeneratör Elkingtons tarafından kullanılmıştı.[21][22][23]
Hamburg 'daki Norddeutsche Affinerie 1876'da üretime başlayan ilk modern elektro kaplama tesisiydi.[24]
Elektrokimya bilimi geliştikçe elektrokaplama ile ilişkisi anlaşıldı ve diğer dekoratif olmayan metal elektro kaplama türleri geliştirildi. Nikel, pirinç, kalay ve çinkonun ticari elektrokaplaması 1850'lerde geliştirildi. Elkingtons'un patentlerine dayanan elektro kaplama banyoları ve ekipmanları çok sayıda büyük ölçekli nesnenin kaplamasına, özel üretim ve mühendislik uygulamalarına uyacak şekilde ölçeklendirildi.
Kaplama endüstrisi 19. yüzyılın sonlarında elektrik jeneratörlerinin gelişmesiyle büyük bir ivme kazandı. Mevcut daha yüksek akımlarla, daha iyi görünümün yanı sıra korozyon koruması ve gelişmiş aşınma özellikleri gerektiren metal makine bileşenleri, donanım ve otomotiv parçaları toplu olarak kaplanabilmektedir.
İki Dünya Savaşı ve büyüyen havacılık endüstrisi, sert krom kaplama, bronz alaşımlı kaplama, sülfamat nikel kaplama ve diğer birçok kaplama işlemi gibi süreçler dahil olmak üzere daha fazla gelişme ve iyileştirmeye ivme kazandırdı. Kaplama ekipmanı, elle çalıştırılan katran astarlı ahşap tanklardan, saatte binlerce kilogram parça kaplayabilen otomatik ekipmanlara dönüştü.
Amerikalı fizikçi Richard Feynman 'ın ilk projelerinden biri metali plastiğe elektrokaplama teknolojisi geliştirmekti. Feynman, arkadaşının orijinal fikrini başarılı bir icat haline getirerek işvereninin (ve arkadaşının) vermiş olduğu ancak başka türlü yerine getiremeyeceği ticari vaatleri tutmasına izin verdi.[25]

Hull hücresi
[değiştir | kaynağı değiştir]
Hull hücresi, elektrokaplama banyosunun durumunu kalitatif olarak kontrol etmek için kullanılan bir tür test hücresidir. Mevcut yoğunluk aralığı için optimizasyona, katkı maddesi konsantrasyonunun optimizasyonuna, kirlilik etkilerinin tanınmasına ve makro fırlatma gücü kapasitesinin gösterilmesine olanak tanır.[26] Hull hücresi, kaplama banyosunu laboratuvar ölçeğinde kopyalar. Doğrultucuya bağlanan uygun anot kaplama çözeltisinin örneği ile doldurulur. "İş", banyonun "sağlığını" göstermek için kaplanacak olan Hull hücre test paneli ile değiştirilir.
Hull hücresi, 267 mL kaplama çözeltisi alan trapezoid bir kaptır. Bu şekil, test panelinin anoda açılı olarak yerleştirilmesine izin verir. Sonuçta kaplama, gövde hücre cetveli ile ölçülebilen farklı akım yoğunluklarında kaplanır. Çözelti hacmi, katkı maddesi konsantrasyonunun miktarsal optimizasyonuna imkan verir: 267 mL ‘ye 1 gram ilavesi kaplama tankında oz/gal 'ye eşittir 0.5.[27]
Haring-Blum hücresi
[değiştir | kaynağı değiştir]Haring – Blum hücresi, kaplama banyosunun makro fırlatma gücünü belirlemek için kullanılır. Hücre, ortasında sabit bir anot bulunan iki paralel katottan oluşur. Katotlar 1:5 oranında anottan uzaktadır. Makro fırlatma gücü, belirli bir süre boyunca doğru akım geçildiğinde iki katottaki kaplama kalınlığından hesaplanır. Hücre, perspeks veya camdan imal edilmiştir.[28][29]
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ "Arşivlenmiş kopya". 28 Kasım 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Aralık 2020.
- ^ Dufour 2006, s. IX-1.
- ^ a b Dufour 2006, s. IX-2
- ^ Dufour 2006
- ^ "Pollution Prevention Technology Profile Trivalent Chromium Replacements for Hexavalent Chromium Plating" (PDF). Northeast Waste Management Officials’ Association. 18 Ekim 2003. 20 Temmuz 2011 tarihinde kaynağından (PDF) arşivlendi.
- ^ US 4882014, Coyle, R. T. & J. A. Switzer, "Electrochemical synthesis of ceramic films and powders"
- ^ Gal-Or (1991). "Electrolytic ZrO2 Coatings: I. Electrochemical Aspects". Journal of the Electrochemical Society. 138 (7): 1939. doi:10.1149/1.2085904.
- ^ Ju (2012). "Fast and selective Cu2O nanorod growth into anodic alumina templates via electrodeposition". Current Applied Physics. 12 (1): 60-64. doi:10.1016/j.cap.2011.04.042.
- ^ kunji durai (2008). "Pulse and pulse reverse plating-Conceptual, advantages and applications". Electrochimica Acta. 53 (8): 3313-3322. doi:10.1016/j.electacta.2007.11.054.
- ^ Proctor (2016). "Inhalation cancer risk assessment of hexavalent chromium based on updated mortality for Painesville chromate production workers". Journal of Exposure Science & Environmental Epidemiology. 26 (2): 224-31. doi:10.1038/jes.2015.77. PMC 4756268 $2. PMID 26669850.
- ^ "Advancements in Brush Plated Metal Matrix Composites". SIFCO ASC. 2018. 23 Temmuz 2020 tarihinde kaynağından arşivlendi.
- ^ Tin and Solder Plating in the Semiconductor Industry. Springer Science & Business Media. 30 Kasım 1992. s. 122. ISBN 978-0-412-48240-3. 1 Ağustos 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Aralık 2020.
- ^ "Surface Coating". Manufacturing Processes Reference Guide. Industrial Press. 1994. ss. 454-458. ISBN 0-8311-3049-0. 9 Ekim 2013 tarihinde kaynağından arşivlendi.
- ^ US 6475644, Hampikian, Janet & Neal Scott, "Radioactive coating solutions methods, and substrates"
- ^ chitsaz, M. R. "Parthian Battery" (PDF). www.sid.ir. Iran University of Science & Technology, School of Architecture & Urban Studies, Tehran. 28 Aralık 2020 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 16 Ekim 2020.
- ^ A galvanic element from the Parthian period
- ^ Keyser, Paul (1993). "The Purpose of the Parthian Galvanic Cells: A First-Century A. D. Electric Battery Used for Analgesia". Journal of Near Eastern Studies. 52 (2): 81-98. doi:10.1086/373610. JSTOR 545563. PMID 16468202. 30 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Ekim 2020 – JSTOR vasıtasıyla.
- ^ "Debunking the So-Called "Baghdad Battery"". Tales of Times Forgotten (İngilizce). 8 Mart 2020. 10 Ekim 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Ekim 2021.
- ^ "The history of galvanotechnology in Russia" (Rusça). 5 Mart 2012 tarihinde kaynağından arşivlendi.
- ^ Birmingham Museums trust catalogue, accession number: 1889S00044
- ^ Michael Faraday and the Royal Institution: The Genius of Man and Place. Bristol: Hilger. 1991. s. 51. ISBN 0750301457.
- ^ Exhibiting Electricity. IET. 1997. s. 90. ISBN 9780852968956.
- ^ Hunt (March 1973). "The early history of gold plating". Gold Bulletin. 6 (1): 16-27. doi:10.1007/BF03215178.
- ^ Stelter (2004). "Process Optimization in Copper Electrorefining". Advanced Engineering Materials. 6 (7): 558. doi:10.1002/adem.200400403.
- ^ "Chapter 6: The Chief Research Chemist of the Metaplast Corporation". Surely You're Joking, Mr. Feynman!. 1985.
- ^ Metal Finishing: Guidebook and Directory. Issue 98. 95. 1998. s. 588.
- ^ "Hull Cell 101". Products Finishing. 1 Aralık 2006. 13 Mart 2010 tarihinde kaynağından arşivlendi.
- ^ "Haring–Blum Cell". Electrochemical Dictionary. Springer. 2012. s. 444. doi:10.1007/978-3-642-29551-5_8. ISBN 978-3-642-29551-5.
- ^ Electrochemical Engineering: Science and Technology in Chemical and Other Industries. Springer. 1999. s. 122. ISBN 3540643869.
