Gemsitabin
 | |
 | |
| Klinik verisi | |
|---|---|
| AHFS/Drugs.com | Monografi |
| ATC kodu | |
| Tanımlayıcılar | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Bilgi Paneli (EPA) | |
| ECHA Bilgi Kartı | 100.124.343 |
| Kimyasal ve fiziksel veriler | |
| Formül | C9H11F2N3O4 |
| Mol kütlesi | 263,201 g·mol−1 |
| 3D model (JSmol) | |
| |
Gemsitabin, kanser tedavisinde kullanılan bir kemoterapi ilacıdır.[1] Testis,[2] meme, yumurtalık, küçük hücreli olmayan akciğer kanseri, pankreas ve mesane kanseri tedavisinde kullanılır.[1][3] İntravenöz infüzyon yoluyla uygulanır.[1] Neoplastik büyümeye karşı etkili olmakla beraber interferon sinyal yolağına etki ederek (upregülasyon) Hepatit E'nin etkeni Ortohepevirüs A'nın replikasyonunu engellemektedir.[4]
Yaygın yan etkiler arasında kemik iliği baskılanması, karaciğer ve böbrek sorunları, mide bulantısı, ateş, döküntü, nefes darlığı, ağız yaraları, ishal, nöropati ve saç dökülmesi yer alır.[1] Fetusa muhtemel zararlı etkileri nedeniyle Hamilelik sırasında kullanımı uygun değildir.[1] Gemsitabin, nükleosit analoğu ilaç ailesindendir.[1] Etki mekanizması yeni DNA oluşumunu engelleyerek hücre ölümüne yol açmak üzerine kuruludur.[1]
1983 yılında patentlenen Gemsitabin 1995 yılında tıbbi kullanım için onaylanmıştır.[5] Jenerik versiyonları 2009'da Avrupa'da ve 2010'da ABD'de piyasaya sürülmüştür.[6][7] DSÖ Temel İlaçlar Model Listesinde yer almaktadır.[8]
Tıbbi kullanımı
[değiştir | kaynağı değiştir]Gemsitabin çeşitli karsinomların tedavisinde kullanılmaktadır. İlk basamak tedavi olarak, Pankreas kanserinde tek başına ve ilerlemiş veya metastatik mesane kanseri ile ilerlemiş veya metastatik küçük hücreli olmayan akciğer kanserinde ise sisplatin ile kombine edilerek kullanılmaktadır. İkinci basamak tedavi olarak, Yumurtalık kanserinde karboplatin ile kombinasyon halinde ve metastatik veya cerrahi olarak çıkarılamayan meme kanserinde ise paklitaksel ile kombinasyon halinde kullanılır.[9][10][11]
Kolanjiyokarsinom[12] ve diğer safra yolu kanserlerinin tedavisinde endikasyon dışı olarak kullanılır.[13]
Kontrendikasyonlar ve İlaç etkileşimleri
[değiştir | kaynağı değiştir]Gemsitabin, erkeklerde ve kadınlarda doğurganlığı, cinsel yaşamı ve menstrüasyonu etkileyebilir. Gemsitabin kullanan kadınlar gebe kalmamalı, hamile ve emziren kadınlarsa bu ilacı kullanmamalıdır.[14]
2014 yılı itibarıyla ilaç etkileşimleri araştırılmamıştır.[9][10]
Yan etkiler
[değiştir | kaynağı değiştir]Gemsitabin, bölünmekte olan tüm hücreleri öldürerek etki eden bir kemoterapi ilacıdır.[9] Kanser hücreleri hızla bölünden Gemsitabin tarafından daha sık hedef alınır. Ancak insan vücudundaki bazı temel sağlıklı hücrelerde hızlı bölünme yetisine sahiptir. Bu diğer hızlı bölünen hücre tiplerini barındıran cilt, kafa derisi, mide zarı ve kemik iliğindeki hücrelere de etki ederek gemsitabin olumsuz yan etkilere yol açar.[15] :265
Gemsitabin prospektüsünde, kemik iliği fonksiyonunu baskılayarak beyaz kan hücrelerinin, trombositlerin ve kırmızı kan hücrelerinin kaybına neden olabileceği ve karaciğer, böbrek veya kardiyovasküler rahatsızlıkları olan kişilerde dikkatli kullanılması gerektiği yönünde uyarılar yer almaktadır. Bu ilacı kullanan kişiler kemik iliği baskılanması ihtimali nedeniyle canlı aşı olmamalıdır. Uyarı etiketinde ayrıca posterior reversibl ensefalopati sendromuna neden olabileceği, Kaçış sendromu hastalığına yol açabileceği, akciğer ödemi, zatürre ve akut solunum sıkıntısı sendromu gibi ciddi akciğer rahatsızlıklarına sebep olabileceği ve spermlere zarar verebileceği belirtilmektedir.[9][16]
İlacı kullananların %10'undan fazlasında çeşitli yan etkiler görülmektedir. Bu yan etkilere nefes darlığı, düşük beyaz ve kırmızı kan hücresi sayısı, düşük trombosit sayısı, mide bulantısı ve kusma, transaminaz yüksekliği, döküntüler ve kaşıntı, saç dökülmesi, idrarda kan ve protein, grip benzeri semptomlar ve ödem örnek olarak verilebilir.[9][14]
Yaygın yan etkilere (kullanıcıların %1-10'unda görülen) ateş, iştah kaybı, baş ağrısı, uyku güçlüğü, yorgunluk, öksürük, burun akıntısı, ishal, ağız ve dudak yaraları, terleme, sırt ağrısı ve kas ağrısı örnek olarak verilebilir.[9]
Trombotik trombositopenik purpura (TTP), gemsitabin de dahil olmak üzere belirli kemoterapi ilaçlarıyla ilişkili nadir görülen fakat ciddi bir yan etkidir. TTP bir kan hastalığıdır ve mikroanjipatik hemolitik anemiye (MAHA), nörolojik anomalilere, yüksek ateşe ve böbrek hastalığına yol açabilir.[17]
Farmakolojisi
[değiştir | kaynağı değiştir]Gemcitabin hidrofildir ve hücrelere nükleozimoleküler taşıyıcılar aracılığıyla taşınmalıdır (gemcitabin için en yaygın taşıyıcılar SLC29A1, SLC28A1 ve SLC28A3'tür). Hücreye girdikten sonra, gemcitabin ilk olarak bir fosfat eklenerek değiştirilir ve gemcitabin monofosfat (dFdCMP) haline gelir. Bu, deoksisitidin kinaz (DCK) enzimi tarafından katalize edilen hız belirleyici adımdır. Diğer enzimler tarafından iki fosfat daha eklenir. Üç fosfatın eklenmesinden sonra, gemcitabin sonunda farmakolojik olarak aktif hale gelir ve gemcitabin trifosfat (dFdCTP) olur.
Gemsitabin hidrofiliktir ve nükleosit moleküler taşıyıcılarla hücre içine taşınmalıdır (en yaygın gemsitabin taşıyıcıları SLC29A1, SLC28A1 ve SLC28A3'tür).[18][19] Gemsitabin hücreye girdikten sonra öncelikle kendisine bir fosfat bağlanarak modifiye edilir ve gemsitabin monofosfata (dFdCMP) dönüşür.[18][19] Bu reaksiyon, deoksisitidin kinaz (DCK) enzimi tarafından katalize edilen hız belirleyici adımdır.[18][19] Diğer enzimler tarafından iki fosfat daha eklenir. Üç fosfatın bağlanmasından sonra gemsitabin nihayet gemsitabin trifosfat (dFdCTP) olarak farmakolojik olarak aktif hale gelir.[18][20]
Gemsitabin, üç kez fosforile edildikten sonra deoksisitidin trifosfat gibi davranarak hücre bölündükçe sentezlenen yeni DNA iplikçiklerine dahil olur.[1][18][19]
Gemsitabin DNA'ya dahil edildiğinde yanına doğal bir nükleosit bazının yanına eklenmesine olanak tanır. Gemsitabin "hatalı" bir baz olduğu için bu durum "maskeli zincir sonlanması"na yol açmaktadır, ancak yanına eklenmesine olanak tanıdığı komşu doğal nükleosit nedeniyle hücrenin normal onarım sisteminden (baz eksizyon onarımı) kaçar. Böylece, gemsitabinin hücre DNA'sına dahil olması onarılamaz bir hataya, DNA sentezinin devamının engellenmesine ve dolayısıyla hücre ölümüne yol açar.[1][18][19]
İki fosfatın bağlı olduğu gemsitabinin formu (dFdCDP) da aktiviteye sahiptir; yeni DNA nükleotitleri oluşturmak için gerekli bir enzim olan ribonükleotit redüktazı (RNR) inhibe eder.Bunun sonucunda ortaya çıkan Nükleotit eksikliği, hücrenin dışarıdan nükleotit yapımı için gerekli bileşenleri daha fazla almasına neden olur ve bu da gemcitabin alımını artırarak gemsitabinin etkisini artırır.[1][18][19][21]
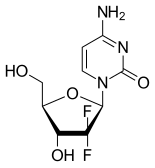
Kimyasal Yapısı
[değiştir | kaynağı değiştir]Sentetik bir pirimidin Nükleosit ön ilaç olan Gemsitabin, Deoksisitidin molekülünün 2' karbonundaki hidrojen atomlarının flor atomları ile değiştirilmesiyle oluşan bir nükleosit analoğudur.[1][22][23]
Aşağıda tarif edilen ve resmedilen sentez, Eli Lilly Company laboratuvarlarında yapılan orijinal sentezdir. Sentez, başlangıç malzemesi olarak, D-mannitol'den 2-7 adımda elde edilebilen, enantiyopür D-gliseraldehit (R)-2 ile başlar. Ardından, Flor atomu, etil bromodifloroasetat kullanılarak "Building block" yaklaşımı ile moleküle sokulur. Sonrasında, standart koşullar altında yapılan Reformatsky reaksiyonuyla, ana ürünü de içeren, 3:1 anti/syn diastereomerik karışım elde edilir. HPLC ile Diastereomerler %65 verimle anti-3 gemsitabin'den ayrıştırılarak son ürün elde edilir.[22][23] Ayrıca, farklı araştırma grupları tarafından geliştirilmiş en az iki başka tam sentez yöntemi daha mevcuttur.[23]

Tarihçesi
[değiştir | kaynağı değiştir]Gemsitabin ilk olarak 1980'lerin başında Larry Hertel'in Eli Lilly and Company'deki laboratuvarında sentezlenmiştir. Başta antiviral bir ilaç olarak planlanan Gemsitabinin preklinik testlerde lösemi hücrelerini in vitro öldürdüğü görüldü.[24]
1990'ların başlarında Gemsitabin klinik çalışmaları başladı . Pankreas kanseri çalışmalarında, gemsitabinin bir yıllık hayatta kalma süresini önemli ölçüde arttırdığı bulunduç Bunun sonucunda, pankreas kanserli hastalar için 1995 yılında İngiltere'de[9] ve 1996 yılında FDA tarafından ABD'de onaylandı.[3] Gemsitabin 1998'de küçük hücreli dışı akciğer kanserinin tedavisi için ve 2004'te ise metastatik meme kanseri için FDA onayı almıştır.[3]
2008 yılında, EMA, Avrupa genelinde ilaç etiketlerini tutarlılık ve açıklık sağlamak amacıyla standartlaştırdı.[25]
2008 itibarıyla Lilly'nin dünya çapındaki gemsitabin satışları yaklaşık 1,7 milyar dolardı; o dönemde ABD patentlerinin süresi 2013'te, Avrupa patentlerinin süresi ise 2009'da dolacaktı.[26] İlk jenerik Gemsitabin 2009 yılında Avrupa'da piyasaya sürüldü[8] ve ABD'deki patent itirazları, ilacın üretim yöntemine ilişkin Lilly'nin önemli bir patentinin geçersiz kılınmasına yol açtı.[27][28] Jenerik ilaç şirketleri, kimyasalın patentinin süresinin dolduğu 2010 yılında ABD'de ilacı satmaya başlamıştır.[7][28] Çin'deki patent davaları ise büyük ilgi gördü ve 2010 yılında çözüme kavuştu.[29]
Araştırmalar
[değiştir | kaynağı değiştir]Klinik olarak değerli olduğu ve sadece damar yoluyla verildiğinde etkili olduğu için, ağızdan alınabilecek şekilde yeniden formüle etme yöntemleri araştırma konusu olmuştur.[30][31][32]
Farmakogenomik ve farmakogenetik alanındaki araştırmalar ıse devam etmektedir. 2014 yılına dek, genetik testlerin dozajı yönlendirmede yararlı olup olmadığı ve hangi kişilerin gemsitabine en iyi yanıt verdiği açık değildi.[18] Bununla birlikte, gemsitabini hücre içine taşıyan taşıyıcı proteinlerin ( SLC29A1, SLC29A2, SLC28A1 ve SLC28A3) ekspresyonundaki varyasyonların, ilacın potensinde farklılıklara yol açtığı görülmektedir. Benzer şekilde, ilacın inaktivasyonuna yol açan proteinleri eksprese eden genler ( deoksisitidin deaminaz, sitidin deaminaz ve NT5C ) ve diğer hücre içi hedeflerini eksprese eden genlerin ( RRM1, RRM2 ve RRM2B ), ilaç yanıtı üzerinde etkili olduğu görüldü.[18] Pankreas kanserlerindeki mutasyonların gemsitabine yanıtını nasıl etkilediğini araştıran çalışmalar devam etmektedir.[33]
Ayrıca Gemsıtabın, gelişmiş ülkeler nazaran gelişmekte olan ülkelerde daha sık görülen ve AIDS'li kişilerde yaygın bir kanser olan Kaposi sarkomunun tedavisi olarak araştırılmıştır.[34]
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b c d e f g h i j k "Gemcitabine Hydrochloride". The American Society of Health-System Pharmacists. 2 Şubat 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 8 Aralık 2016.
- ^ "Drug Formulary/Drugs/ gemcitabine - Provider Monograph". Cancer Care Ontario. 24 Şubat 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Aralık 2020.
- ^ a b c "FDA Approval for Gemcitabine Hydrochloride". National Cancer Institute. 5 Ekim 2006. 5 Nisan 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Nisan 2017.
- ^ "Drug screening identified gemcitabine inhibiting hepatitis E virus by inducing interferon-like response via activation of STAT1 phosphorylation". Antiviral Research. 184: 104967. December 2020. doi:10.1016/j.antiviral.2020.104967. PMID 33137361.
- ^ Analogue-based Drug Discovery. John Wiley & Sons. 2006. s. 511. ISBN 9783527607495. 12 Ocak 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Aralık 2022.
- ^ "Gemcitabine from Actavis launched on patent expiry in EU markets". FierceBiotech (İngilizce). 13 Mart 2009. 11 Eylül 2017 tarihinde kaynağından arşivlendi.
- ^ a b "Press release: Hospira launches two-gram vial of gemcitabine hydrochloride for injection" (İngilizce). Hospira via News-Medical.Net. 16 Kasım 2010. 2 Ekim 2015 tarihinde kaynağından arşivlendi.
- ^ a b The selection and use of essential medicines 2023: web annex A: World Health Organization model list of essential medicines: 23rd list (2023). Cenevre: World Health Organization. 2023. WHO/MHP/HPS/EML/2023.02.
- ^ a b c d e f g "UK label" (İngilizce). UK Electronic Medicines Compendium. 5 Haziran 2014. 10 Temmuz 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2017.
- ^ a b "US formLabel" (PDF). FDA. June 2014. 16 Şubat 2017 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Mayıs 2017. For label updates see FDA index page for NDA 020509 29 Nisan 2017 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ "Gemcitabine in Combination with a Second Cytotoxic Agent in the First-Line Treatment of Locally Advanced or Metastatic Pancreatic Cancer: a Systematic Review and Meta-Analysis". Targeted Oncology. 12 (3): 309-321. June 2017. doi:10.1007/s11523-017-0486-5. PMID 28353074.
- ^ "Systemic Therapy of Cholangiocarcinoma". Visceral Medicine. 32 (6): 427-430. December 2016. doi:10.1159/000453084. PMC 5290432 $2. PMID 28229078.
- ^ "Genomic Profiling of Biliary Tract Cancers and Implications for Clinical Practice". Current Treatment Options in Oncology. 17 (11): 58. November 2016. doi:10.1007/s11864-016-0432-2. PMID 27658789.
- ^ a b "Gemcitabine". Macmillan Cancer Support. 25 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Mayıs 2017.
- ^ Rachel Airley (2009). Cancer Chemotherapy. Wiley-Blackwell. ISBN 978-0-470-09254-5.
- ^ "Capillary leak syndrome: etiologies, pathophysiology, and management". Kidney International. 92 (1): 37-46. July 2017. doi:10.1016/j.kint.2016.11.029. PMID 28318633.
- ^ "Thrombotic thrombocytopenic purpura and gemcitabine". Case Reports in Oncology. 4 (1): 143-148. January 2011. doi:10.1159/000326801. PMC 3114619 $2. PMID 21691573.
- ^ a b c d e f g h i "PharmGKB summary: gemcitabine pathway". Pharmacogenetics and Genomics. 24 (11): 564-574. November 2014. doi:10.1097/fpc.0000000000000086. PMC 4189987 $2. PMID 25162786.
- ^ a b c d e f "Cellular pharmacology of gemcitabine". Annals of Oncology. 17 (Suppl 5): v7-12. May 2006. doi:10.1093/annonc/mdj941. PMID 16807468.
- ^ Fatima, M., Iqbal Ahmed, M. M., Batool, F., Riaz, A., Ali, M., Munch-Petersen, B., & Mutahir, Z. (2019). Recombinant deoxyribonucleoside kinase from Drosophila melanogaster can improve gemcitabine based combined gene/chemotherapy for targeting cancer cells. Bosnian Journal of Basic Medical Sciences, 19(4), 342-349. https://doi.org/10.17305/bjbms.2019.4136
- ^ "Understanding ribonucleotide reductase inactivation by gemcitabine". Chemistry: A European Journal. 13 (30): 8507-8515. 2007. doi:10.1002/chem.200700260. PMID 17636467.
- ^ a b "A linear synthesis of gemcitabine". Carbohydrate Research. 406: 71-75. April 2015. doi:10.1016/j.carres.2015.01.001. PMID 25681996.
- ^ a b c "The synthesis of gemcitabine". Carbohydrate Research. 387: 59-73. March 2014. doi:10.1016/j.carres.2014.01.024. PMID 24636495.
- ^ Sneader, Walter (2005). Drug discovery: a history. New York: Wiley. s. 259. ISBN 978-0-471-89979-2.
- ^ "Gemzar" (İngilizce). European Medicines Agency. 24 Eylül 2008. 11 Eylül 2017 tarihinde kaynağından arşivlendi.
- ^ "Patent for Lilly's cancer drug Gemzar invalidated". FiercePharma (İngilizce). 18 Ağustos 2009. 11 Eylül 2017 tarihinde kaynağından arşivlendi.
- ^ "Unpredictability in Patent Law and Its Effect on Pharmaceutical Innovation" (PDF). Missouri Law Review. 76 (3): 645-693. Yaz 2011. 11 Eylül 2017 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 6 Mayıs 2017.
- ^ a b "On the Generic Gemzar Patent Fight". Seeking Alpha. 28 Temmuz 2010. 9 Aralık 2012 tarihinde kaynağından arşivlendi.
- ^ "Analysis of Cases on Pharmaceutical Patent Infringement in Great China". Law, Politics and Revenue Extraction on Intellectual Property (İngilizce). Cambridge Scholars Publishing. 2015. s. 119. ISBN 9781443879262. 11 Eylül 2017 tarihinde kaynağından arşivlendi.
- ^ "Lessons Learned from Gemcitabine: Impact of Therapeutic Carrier Systems and Gemcitabine's Drug Conjugates on Cancer Therapy". Critical Reviews in Therapeutic Drug Carrier Systems. 34 (1): 63-96. 2017. doi:10.1615/CritRevTherDrugCarrierSyst.2017017912. PMID 28322141.
- ^ "Nanotechnology for delivery of gemcitabine to treat pancreatic cancer". Biomedicine & Pharmacotherapy. 88: 635-643. April 2017. doi:10.1016/j.biopha.2017.01.071. PMID 28142120.
- ^ "Recent advances in drug delivery strategies for improved therapeutic efficacy of gemcitabine". European Journal of Pharmaceutical Sciences. 93: 147-162. October 2016. doi:10.1016/j.ejps.2016.08.021. PMID 27531553.
- ^ "Therapeutic Implications of Molecular Subtyping for Pancreatic Cancer". Oncology. 31 (3): 159-66, 168. March 2017. PMID 28299752. 3 Temmuz 2017 tarihinde kaynağından arşivlendi.
- ^ "Treatment strategies for Kaposi sarcoma in sub-Saharan Africa: challenges and opportunities". Current Opinion in Oncology. 23 (5): 463-468. September 2011. doi:10.1097/cco.0b013e328349428d. PMC 3465839 $2. PMID 21681092.
Dış bağlantılar
[değiştir | kaynağı değiştir]- "Gemcitabine". Drug Information Portal. U.S. National Library of Medicine. 29 Kasım 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 30 Aralık 2022.
