Bakteri
| Bakteri | |||
|---|---|---|---|
 Escherichia coli bakterilerinin taramalı elektron mikroskopisi ile elde edilmiş bir görüntüsü | |||
| Biyolojik sınıflandırma | |||
| |||
| Şubeler | |||
| |||
| Sinonimler | |||
| |||
| Biyoloji |
|---|
Bakteri (İngilizce telaffuz: [bækˈtɪəriə] (![]() dinle); tekil isim: bacterium), tek hücreli mikroorganizma grubudur. Tipik olarak birkaç mikrometre uzunluğunda olan bakterilerin çeşitli şekilleri vardır, kimi küresel, kimi spiral şekilli, kimi çubuksu, kimi virgül şeklinde olabilir. Yeryüzündeki hemen hemen her ortamda bakteriler mevcuttur. Toprakta, deniz suyunda, okyanusun derinliklerinde, yer kabuğunda, deride, hayvanların bağırsaklarında, asitli sıcak su kaynaklarında, radyoaktif atıklarda[4] büyüyebilen tipleri vardır. Tipik olarak bir gram toprakta bulunan bakteri hücrelerinin sayısı 40 milyon, bir mililitre tatlı suda ise bir milyondur; toplu olarak dünyada beş nonilyon (5×1030) bakteri bulunmaktadır,[5] bunlar dünyadaki biyokütlenin çoğunu oluşturur.[5] Bakteriler gıdaların geri dönüşümü için hayati bir öneme sahiptirler ve gıda döngülerindeki çoğu önemli adım, atmosferden azot fiksasyonu gibi, bakterilere bağlıdır. Ancak bu bakterilerin çoğu henüz tanımlanmamıştır ve bakteri şubelerinin sadece yaklaşık yarısı laboratuvarda kültürlenebilen türlere sahiptir.[6] Bakterilerin araştırıldığı bilim bakteriyolojidir, bu, mikrobiyolojinin bir dalıdır.
dinle); tekil isim: bacterium), tek hücreli mikroorganizma grubudur. Tipik olarak birkaç mikrometre uzunluğunda olan bakterilerin çeşitli şekilleri vardır, kimi küresel, kimi spiral şekilli, kimi çubuksu, kimi virgül şeklinde olabilir. Yeryüzündeki hemen hemen her ortamda bakteriler mevcuttur. Toprakta, deniz suyunda, okyanusun derinliklerinde, yer kabuğunda, deride, hayvanların bağırsaklarında, asitli sıcak su kaynaklarında, radyoaktif atıklarda[4] büyüyebilen tipleri vardır. Tipik olarak bir gram toprakta bulunan bakteri hücrelerinin sayısı 40 milyon, bir mililitre tatlı suda ise bir milyondur; toplu olarak dünyada beş nonilyon (5×1030) bakteri bulunmaktadır,[5] bunlar dünyadaki biyokütlenin çoğunu oluşturur.[5] Bakteriler gıdaların geri dönüşümü için hayati bir öneme sahiptirler ve gıda döngülerindeki çoğu önemli adım, atmosferden azot fiksasyonu gibi, bakterilere bağlıdır. Ancak bu bakterilerin çoğu henüz tanımlanmamıştır ve bakteri şubelerinin sadece yaklaşık yarısı laboratuvarda kültürlenebilen türlere sahiptir.[6] Bakterilerin araştırıldığı bilim bakteriyolojidir, bu, mikrobiyolojinin bir dalıdır.
İnsan vücudunda bulunan bakteri sayısı, insan hücresi sayısının yaklaşık olarak 1,3 katı kadardır, özellikle deride ve sindirim yolu içinde çok sayıda bakteri bulunur.[7] Bunların çok büyük çoğunluğu bağışıklık sisteminin koruyucu etkisiyle zararsız kılınmış durumda olsalar ve ayrıca bir kısmı yararlı (probiyotik) olsalar da, bazıları patojen bakterilerdir ve enfeksiyöz hastalıklara neden olurlar; kolera, frengi, şarbon, cüzzam ve veba bu cins hastalıklara dahildir. En yaygın ölümcül bakteriyel hastalıklar solunum yolu enfeksiyonlarıdır, bunlardan verem tek başına yılda iki milyon kişi öldürür, bunların çoğu Sahra altı Afrika'da bulunur.[8] Kalkınmış ülkelerde bakteriyel enfeksiyonların tedavisinde ve çeşitli hayvancılık faaliyetlerinde antibiyotikler kullanılır, bundan dolayı antibiyotik direnci yaygınlaşmaktadır. Endüstride bakteriler, atık su arıtması, peynir ve yoğurt üretimi, biyoteknoloji, antibiyotik ve diğer kimyasalların imalatında önemli rol oynarlar.[9]
Bir zamanlar bitkilerin Schizomycetes sınıfına ait sayılan bakteriler artık prokaryot olarak sınıflandırılırlar. ökaryotlardan farklı olarak bakteri hücreleri hücre çekirdeği içermez, membran kaplı organeller de ender olarak görülür. Geleneksel olarak bakteri terimi tüm prokaryotları içermiş ancak, 1990'lı yıllarda yapılan keşiflerle prokaryotların iki farklı gruptan oluştuğu, bunların ortak bir atadan ayrı ayrı evrimleşmiş oldukları bulununca bilimsel sınıflandırma değişmiştir. Bu üst alemler Bacteria ve Archaea olarak adlandırılmıştır.[10]
Bakteriyolojinin tarihçesi
[değiştir | kaynağı değiştir]
Bakteriler ilk defa 1676'da Antonie van Leeuwenhoek tarafından, kendi tasarımı olan tek mercekli bir mikroskopla gözlemlenmiştir.[11] Onlara "animalcules" (hayvancık) adını takmış, gözlemlerini Kraliyet Derneği'ne (Royal Society'ye) yazılmış bir dizi mektupla yayımlamıştır.[12][13][14] Bacterium adı çok daha sonra, 1838'de Christian Gottfried Ehrenberg tarafından kullanıma sokulmuş, Antik Yunanca "küçük asa" anlamına gelen βακτήριον -α (bacterion -a)'dan türetilmiştir.[15] Latince kullanımıyla Bacteria, bakteri sözcüğünün çoğulu, bacterium ise tekilidir.
Louis Pasteur 1859'da fermantasyonun mikroorganizmaların büyümesi sonucu meydana geldiğini ve bu büyümenin yoktan varoluş yoluyla olmadığını gösterdi. (Genelde fermantasyon kavramıyla ilişkilendirilen maya ve küfler, bakteri değil, mantardır.) Kendisiyle ayni dönemde yaşamış olan Robert Koch ile birlikte Pasteur, hastalık-mikrop teorisi'nin erken bir savunucusu olmuştur.[16] Robert Koch tıbbi mikrobiyolojide bir öncü olmuş, kolera, şarbon ve verem üzerinde çalışmıştır. Verem üzerindeki araştırmalarında Koch mikrop (germ) teorisini kanıtlamış, bundan dolayı da kendisine Nobel Ödülü verilmiştir.[17] Koch postülatları'nda bir canlının bir hastalığın nedeni olduğunu belirlemek için gereken testleri ortaya koymuştur; bu postülatlar günümüzde hâlâ kullanılmaktadır.[18]
On dokuzuncu yüzyılda bakterilerin çoğu hastalığın nedeni olduğu bilinmesine rağmen, antibakteriyel bir tedavi mevcut değildi.[19] 1910'da Paul Ehrlich Treponema pallidum 'u (frengiye neden olan spiroket) seçici olarak boyamaya yarayan boyaları değiştirerek bu patojeni seçici olarak öldüren bileşikler elde etti, böylece ilk antibiyotiği geliştirmiş oldu.[20] Ehrlich, bağışıklık üzerine yaptığı çalışmasından dolayı 1908 Nobel ödülünü kazanmış, ayrıca bakterilerin kimliğini tespit etmek için boyaların kullanılmasına öncülük etmiştir; çalışmaları Gram boyası ve Ziehl-Neelsen boyasının temelini oluşturmuştur.[21]
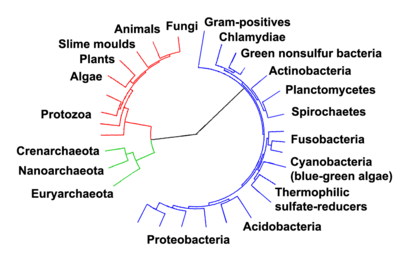
Bakterilerin araştırılmasında büyük bir aşama, Arkelerin bakterilerden farklı bir evrimsel soya ait olduklarının 1977'de Carl Woese tarafından anlaşılmasıdır.[22] Bu yeni filogenetik taksonomi, 16S ribozomal RNA'nın dizilenmesine dayandırılmış ve üç alanlı sistem'in parçası olarak prokaryot alemini 2 evrimsel alana (üst âleme) bölünmüştür.[2]
Köken ve erken evrim
[değiştir | kaynağı değiştir]Modern bakterilerin ataları, yaklaşık 4 milyar yıl önce, dünyada gelişen ilk yaşam biçimi olan tek hücreli mikroorganizmalardı. Yaklaşık 3 milyar yıl boyunca tüm canlılar mikroskopiktiler, bakteri ve arkeler yaşamın başlıca biçimleriydi.[23][24] Bakteri fosilleri, örneğin stromatolitler, mevcut olmakla beraber, bunların kendine has morfolojilerinin olmaması, bunlar kullanılarak bakteri evriminin anlaşılmasına veya belli bakteri türlerinin kökeninin belirlenmesini engellemektedir. Ancak gen dizileri bakteri filogenetiğinin inşası için kullanılabilir, bu çalışmalar bakterilerin arke/ökaryot soyundan ayrılmış evrimsel bir dal olduğunu göstermiştir.[25] Bakteri ve arkelerin en yakın zamanlı ortak atası muhtemelen yaklaşık 2,5-3,2 milyar yıl önce yaşamış bir hipertermofil'di.[26][27]
Bakteriler, evrimdeki ikinci büyük ayrışmada, ökaryotların arkelerden oluşmasında da yer almışlardır. Bunda, eski bakteriler, ökaryotların ataları ile endosimbiyotik bir ilişki kurmuşlardır.[28][29] Bu süreçte, proto-ökaryotik hücreler, alfa-proteobakteriyel hücreleri içlerine alıp mitokondri veya hidrojenozomları oluşturdular. Bu organeller günümüz ökaryotlarının tümünde hala bulunmaktadır ("mitokondrisiz" protozoalarda dahi aslında son derece küçülmüş olarak mevcutturlar). Daha sonraki bir dönemde, farklı bir olay sonucu, bazı mitokondrili ökaryotların, siyanobakteri-benzeri canlıları içlerine alması sonucunda, bitki ve yosunlardaki kloroplastlar oluştu. Hatta bazı yosun gruplarında bu olayı izleyen başka içe almalar meydana gelmiş, bazı heterotrofik ökaryotik konak hücrelerin, ökaryotik bir alg hücresini içine alması sonucunda "ikinci kuşak" bir plastid oluşmuştur.[30][31]
Morfoloji
[değiştir | kaynağı değiştir]
Bakteriler, morfoloji olarak adlandırılan, şekil ve boyutları bakımından büyük bir çeşitlilik gösterir. Bakteriyel hücreler ökaryotik bir hücrenin yaklaşık onda biri boyundadır, tipik olarak 0,5-5,0 mikrometre uzunluktadırlar. Ancak, birkaç tür, örneğin Thiomargarita namibiensis ve Epulopiscium fishelsoni yarı milimetre boyunda olabilir ve çıplak gözle görülebilir.[32] En küçük bakteriler arasında Mikoplazma cinsinin üyeleri bulunur, 0,3 mikrometre olan bu bakteriler en büyük virüsler kadar küçüktür.[33] Bazı bakteriler daha da küçük olabilirler ama bu ultramikrobakteriler henüz iyi tanımlanmamıştır.[34]
Çoğu bakteri türleri ya küresel ya da çubuksu şekilli olur. Küresel olanlar kokus (veya coccus; Antik Yunanca tohum anlamında kókkos 'tan), çubuksu olanlar basil (Latince çubuk anlamlı baculus 'tan) olarak adlandırılır. Vibrio olarak adlandırılan bazı çubuksu bakteriler biraz eğri veya virgül şekillidir; diğerleri spiral şekillidir, spirillum olarak adlandırılır veya sıkıca sarılı olur, spiroket olarak adlandırılırlar. Az sayıda bazı türler tetrahedron veya küp benzeri şekilde olabilirler.[35] Yakın zamanda keşfedilen bazı bakteriler uzun çubuk şeklinde büyür ve yıldız şekilli bir kesite sahiptir. Bu morfolojinin sağladığı yüksek yüzölçümü-hacim oranı bu bakterilere az besinli ortamlarda bir avantaj sağladığı öne sürülmüştür.[36] Hücre şekillerindeki bu büyük çeşitlilik bakterinin hücre duvarı ve hücre iskeleti tarafından belirlenir. Hücre şekli, bakterinin gıda edinmesine, yüzeylere bağlanmasına, sıvı içinde yüzmesine ve doğal avcılarından kaçmasına etki eder.[37][38]
Çoğu bakteriyel tür tek hücre halinde varlığını sürdürür, diğerleri ise kendilerine özgü biçimlerle birbirlerine bağlanır: Neisseria diploitler (ikililer) oluşturur, Streptokok zincir, Stafilokok üzüm salkımı gibi kümeler oluşturur. Bazı bakteriler iplik (filament) oluşturacak şekilde uzayabilir Actinobacteria'da olduğu gibi. İpliksi bakterilerde çoğu zaman içinde pek çok hücre bulunan bir kın vardır. Bazı tipleri, örneğin Nocardia cinsine ait bazı türler, hatta karmaşık, dallı iplikçikler oluşturur, bunlar küflerdeki miselyuma benzer.[39]

Bakteriler yüzeylere bağlanıp biyofilm denen yoğun kümeler oluştururlar. Bu filmler birkaç mikrometre kalınlıktan yarım metre derinliğe kadar değişebilir ve birden çok bakteri, Protista ve arke türü içerebilir. Biyofilmlererde yaşayan bakteriler, hücre ve hücre dışı bileşenler ile karmaşık bir düzen oluştururlar. Meydana gelen ikincil yapılar arasında mikrokoloniler de sayılabilir, bunların içinde bulunan kanal şebekleri gıdaların daha kolay difüzyonunu sağlar.[40][41] Doğal ortamlarda, örneğin toprak ve bitkilerin yüzeyinde, bakterilerin çoğunluğu biyofilim aracılığıyla yüzeye bağlanır.[42] Biyofimler tıpta da önemlidir, çünkü bu yapılar kronik bakteriyel enfeksiyonlarda ve vücut içine yerleştirilmiş tıbbi cihazlarda bulunurlar. Biyofilmler içinde kendini koruyan bakterilerin imhası, tek başına ve izole durumda olan bakterilerinkinden çok daha zordur.[43]
Daha karmaşık morfolojik değişiklikler de bazen mümkündür. Örenğin amino asitlerden yoksun kalınca Myxobacteria'lar civarlarındaki diğer hücreleri algılamak için yeter çoğunluk algılaması (İngilizce: quorum sensing) denen bir süreç kullanırlar. Bu süreçte bakteriler birbirlerine doğru hareket eder ve yaklaşık 100.000 bakteri içeren 500 mikrometre büyüklüğünde tohum yapıları (İngilizce: fruiting bodies) oluştururlar.[44] Tohum yapılarında bulunan bakteriler farklı görevler yerine getirir; böylesi bir kooperasyon, çok hücreli organizasyonun basit bir tipini meydana getirir. Örneğin, her on hücreden biri bu tohum yapılarının tepesine göç eder ve miksospor adında özelleşmiş uyuşuk (dormant) bir yapı oluştururlar. Miksosporlar normal hücrelere kıyasla kurumaya ve diğer olumsuz çevresel şartlara daha dayanıklıdır.[45]
Hücresel yapı
[değiştir | kaynağı değiştir]
Hücre içi yapılar
[değiştir | kaynağı değiştir]Bakteri hücresi hücre zarı olarak adlandırılan bir lipit zarla çevrilidir. Bu zar, hücrenin içindekiler içine alıp besinler, protein ve sitoplazmanın diğer gerekli bileşenlerini hücrenin içinde tutar. Bakteriler prokaryot olduklarından dolayı sitoplazmalarında ender olarak zar kaplı organeller bulundururlar, içlerinde büyük boylu yapılardan az sayıda olur. Bakterilerde hücre çekirdeği, mitokondrisi, kloroplast ve ökaryotlarda bulunan, Golgi aygıtı ve endoplazmik retikulum gibi diğer organellerden yoktur.[46] Bir zamanlar bakterilerin sadece sitoplazmadan içeren basit torbalar olduğu düşünülürdü ama artık karmaşık bir yapıları olduğu bilinmektedir, örneğin prokaryotik hücre iskeleti,[47][48] ve bazı proteinlerin bakteriyel sitoplazmanın belli konumlarında stabil olarak konuşlanması[49] gibi. Hücre içi organizasyonun bir diğer seviyesi mikrokompartımanlaşma ile sağlanır.[50] Bunun bir örneği olan karboksizom, lipit membran yerine, polihedral bir protein kabukla çevrili olan bir bölmedir.[51] Bu polihedral organeller, ökaryotlardaki zar kaplı organellere benzer bir şekilde, bakteri metabolizmasının bölümlerinin hücre içinde konuşlanmasını ve birbirlerinden ayrı tutulmasını sağlar.[52]
Çoğu önemli biyokimyasal tepkime, örneğin enerji üretimi, membran aşırı bir konsantrasyon gradyanı ile, bir bataryadakine benzer şekilde, potansiyel fark oluşması sonucu meydana gelir. Bakterilerde genelde dahilî zarlı yapıların olmaması nedeniyle, elektron taşıma zinciri gibi bu tür tepkimeler, hücre zarının iki yanı arasında, yani sitoplazma ile periplazmik aralık veya hücre dışı arasında oluşur.[53] Ancak, çoğu fotosentetik bakteride plazma zarı çok kıvrımlıdır, hücrenin çoğunu ışık enerjisi toplayan membran tabakaları ile doldurur.[54] Yeşil kükürt bakterilerinde bu ışık toplayıcı komplekslerin kimisi klorozom adlı lipit örtülü yapılar oluşturur.[55] Başka proteinler hücre zarından içeri besin ithal eder veya atık maddeleri sitoplazmadan dışarı atar.

Bakterilerin genetik malzemeleri tipik olarak tek bir dairesel kromozomdan oluşur. Bakterilerde zar kaplı bir çekirdek yoktur ve kromozom tipik olarak sitoplazmada yer alan, nükleoit olarak adlandırılan düzensiz şekilli bir cismin içinde yer alır.[57] Nükleoitte DNA, onunla ilişkili proteinler ve RNA bulunur. Planctomycetes ordosu, bakterilerde dahilî zarlı yapıların bulunmadığı kuralının bir istisnasını oluşturur, bunlarda bulunan nükloit zar çevrilidir, ayrıca bu bakteriler başka zar çevrili hücresel yapılara da sahiptirler.[58] Tüm canlılar gibi bakterilerde de protein üretimi için ribozomlar bulunur, ancak bakteriyel ribozomların yapısı arke ve ökaryot ribozomlarınınkinden farklıdır.[59]
Bazı bakteriler, hücre içinde glikojen,[60] polifosfat,[61] kükürt[62] veya polihidroksialkanoat[63] gibi besinler için depo granülleri oluştururlar. Bu granüller bakterinin daha sonradan kullanması için bu bileşikleri depolamasını sağlar. Bazı bakteri türleri, fotosentetik siyanobakteriler gibi, dahilî gaz vezikülleri oluştururlar, bunlar aracılığıyla hafifliklerini ayarlarlar, farklı miktarda ışık ve besin bulunan su seviyeleri arasında alçalıp yükselebilirler.[64]
Hücre dışı yapılar
[değiştir | kaynağı değiştir]Hücre zarının dışında bakteriyel hücre duvarı bulunur. Bakteriyel hücre duvarları peptidoglikan (eski metinlerde mürein olarak adlandırılırdı)'dan oluşur. Peptidoglikan, peptit zincirlerle birbirine çapraz bağlanmış polisakkarit zincirlerden oluşur, bu peptitler, hücredeki diğer protein ve peptitlerden farklı olarak, D-amino asitler içerir.[65] Bakteri hücre duvarları bitki ve mantar hücre duvarlarından farklıdırlar; bitki hücre duvarları selülozdan, mantarlarınkiler ise kitinden oluşur.[66] Bakteri hücre duvarları arkelerinkinden de farklıdır, bunlarda peptidoglikan bulunmaz. Hücre duvarı çoğu bakterinin varlığını sürdürmesi için gereklidir, bu yüzden bir antibiyotik olan penisilin tarafından peptidoglikan sentezinin engellemesi bakterilerin ölümüne neden olur.[66]
Bakterilerde başlıca iki tip hücre duvarı olduğu söylenebilir, bunlar Gram-negatif ve Gram-pozitif olarak adlandırılır. Bu adlar, hücrelerin Gram boyasıyla tepkimesinden kaynaklanır. Bu, bakterilerin sınıflandırılmasında çok eskiden beri kullanılan bir testtir.[67]
Gram-pozitif hücreler, pek çok peptidoglikan ve teikoik asit tabakasından oluşan kalın bir hücre duvarına sahiptir. Buna karşın, Gram-negatif bakteriler birkaç peptidoglikan tabakası bulunur, bunun etrafını ikinci bir hücre zarı sarar, bu zarda lipopolisakkaritler ve lipoproteinler bulunur. Çoğu bakteri Gram-negatif bir hücre duvarına sahiptir, sadece Firmicutes ve Actinobacteria'lar (bunlar daha evvel düşük G+C ve yüksek G+C Gram pozitif bakteriler diye bilinirdi) Gram-pozitif, düzene sahiptirler.[68] Bu yapısal farklılık, antibiyotiklere duyarlılıkta farklılık yaratabilir; örneğin vankomisin Gram-pozitif bakterileri öldürmesine karşın, Haemophilus influenzae veya Pseudomonas aeruginosa gibi Gram-negatif patojenlere karşı etkisizdir.[69]
Çoğu bakteride hücrenin dışını proteinlerden oluşmuş sert bir bir S-tabakası kaplar.[70] Bu tabaka, hücre yüzeyine kimyasal ve fiziksel bir koruma sağlar ve makromoleküllerin difüzyonuna karşı bir engel oluşturur. S-tabakalarının çeşitli, ama az anlaşılmış işlevleri vardır. Kampilobakter'lerde virülans faktörü olarak etki ettikleri ve Bacillus stearothermophilus 'ta yüzey enzimleri içerdikleri bilinmektedir.[71]

Kamçılar (flagellum, çoğul hali flagella), sert protein yapılardır, çapları yaklaşık 20 nanometre olup uzunlukları 20 mikrometreyi bulabilir, hareket etmeye yararlar. Kamçının hareketi için gereken enerji, hücre zarının iki yanı arasındaki bir elektrokimyasal gradyan boyunca iyonların taşınması sonucu elde edilir.[72]
Fimbrialar ince protein iplikçiklerdir, sadece 2-10 nanometre çaplı olup uzunlukları birkaç mikrometreyi bulabilir. Hücrenin yüzeyine dağılıdırlar, elektron mikroskobunda ince saçlara benzerler. Fimbriaların, sert yüzeylere veya başka hücrelere bağlanmakla ilişkili oldukları sanılmaktadır ve bazı bakterilerin virülansı için gereklidirler.[73] Piluslar fimbrialardan biraz daha büyük hücresel uzantılardır, konjügasyon denen bir süreç ile bakteri hücreleri arasında genetik malzeme aktarılmasını sağlarlar (aşağıda bakteri genetiği ile ilgili bölüme bakınız).[74]
Çoğu bakteri kapsül veya sümük tabakaları üreterek kendilerini bunlarla çevreler. Bu yapılar farklı derecede karmaşıklık gösterir: hücre dışı bir polimer olan sümük tabakası tamamen düzensizdir, kapsül veya glikokaliks ise çok düzenlidir. Bu yapılar, bakterileri makrofaj gibi ökaryotik hücreler tarafından yutulmaya karşı korur.[75] Bunlar ayrıca antijen olarak etki edip hücre tanınmasında rol oynayabilir, ayrıca yüzeylere bağlanmak ve biyofilm oluşmasına yardımcı olabilir.[76]
Bu hücre dışı yapıların bir araya gelmesi salgı sistemlerine dayalıdır. Bunlar proteinleri sitoplazmadan periplazmaya veya hücre dışı ortama aktarırlar. Çeşitli salgı sistemleri bilinmektedir ve bu yapılar virülans için gerekli olduğu için yoğun bir şekilde araştırılmaktdadır.[77]
Endosporlar
[değiştir | kaynağı değiştir]
Bazı Gram-pozitif bakteri cinsleri, örneğin Bacillus, Clostridium, Sporohalobacter, Anaerobacter and Heliobacterium, endospor adlı çok dayanıklı, uyuşuk ('dormant') yapılar oluşturabilir.[78] Hemen her örnekte üremeyle ilişkili olmayan bir süreç sonucunda bir hücreden bir endospor oluşur; ancak Anaerobacter durumunda bir hücrenin içinde oluşabilecek endospor sayısı yediyi bulabilir.[79] Endosporların merkezinde, içinde DNA ve ribozomlar olan bir sitoplazma, bunun etrafında ise korteks tabakası, en dışta ise su geçirmez ve sert bir örtü bulunur.
Endosporlar bir metabolizma belirtisi göstermezler, aşırı kimyasal ve fiziksel baskılara dayanıklıdırlar, örneğin, morötesi ışın, gama ışınları, deterjanlar, dezenfektanlar, ısı, basınç ve kurutulma.[80] Bu uyuşuk halde bu organizmalar milyonlarca yıl boyunca tekrar yaşama geri dönebilirler.[81][82] Endosporlar bakterilerin uzaydaki boşluk ve radyasyona dayanmalarını sağlar.[83] Endospor oluşturan bakterilerin bazıları hastalık da yapar: örneğin şarbon hastalığı Bacillus anthracis endosporlarının teneffüsüyle kapılabilir, derin saplanma yaralarının Clostridium tetani endosporları ile kontamine olması da tetanosa yol açar.[84]
Metabolizma
[değiştir | kaynağı değiştir]Üst organizmalardan farklı olarak bakterilerde görülen metabolik tipler büyük bir çeşitlilik sergiler.[85] Metabolik özelliklerin bir bakteri grubu içinde dağılımı geleneksel olarak onların taksonomisini tanımlamak için kullanılmıştır ama bu özellikler çoğu zaman modern genetik sınıflandırmaya karşılık gelmez.[86] Bakteriyel metabolizmayı besinsel gruplara göre ayırırken üç ana kıstas kullanılar: büyüme için kullanılan enerji türü, karbon türü ve elektron vericisi. Solunum yapan mikroorganizmalar için kullanılan bir diğer kıstas, aerobik veya anaerobik solunum için kullanılan elektron alıcılarıdır.[87]
| Beslenme tipi | Enterji kaynağı | Karbon kaynağı | Örnekler |
|---|---|---|---|
| Fototroflar | Güneş ışığı | Organik bileşikler (fotoheterotrofler) veya karbon fiksasyonu (fotoautotroflar) | Siyanobakteriler, Yeşil kükürt bakterileri, Chloroflexi veya Mor bakteriler |
| Litotroflar | İnorganik bileşikler | Organik bileşikler (litoheterotroflar) veya karbon fiksasyonu (litoautotroflar) | Thermodesulfobacteria, Hydrogenophilaceae veya Nitrospirae |
| Organotroflar | Organik bileşikler | Organik bileşikler (kemoheterotroflar) veya karbon fiksasyonu (kemoototroflar) | Bacillus, Clostridium veya Enterobacteriaceae |
Bakterilerde karbon metabolizması ya heterotrofiktir, organik bileşikler karbon kaynağı olarak kullanılır veya ototrofiktir, yani hücresel karbon, karbon dioksitin karbon fiksasyonu elde edilir. Tipik ototrofik bakteriler arasında fototrofik siyanobakteriler, yeşil kükürt bakterileri ve bazı mor bakteriler sayılabilir, ama pek çok kemolitrofik türler de, örneğin azotlayıcı ve kükürt yükseltgeyici bakteriler de bu grupta yer alır.[88] Bakterilerin enerji metabolizması ya fototrofiye, yani ışığın fotosentez yoluyla kullanımına ya da kemotrofiye, yani enerji için kimyasal bileşiklerin kullanımıdır ki bu bileşiklerin çoğu oksijen veya ona alternatif başka elektron alıcıları yoluyla yükseltgenir (aerobik veya anaerobik solunum).
Nihayet, bakteriler ya inorganik ya da organik bileşikler elektron vericileri kullanmalarına göre, sırasıyla, litotrof veya organotrof olarak siniflanirlar. Kemotrofik organizmalar, hem enerji korunumu (solunum veya fermantasyon ile) hem de biosentetik tepkimeler için bu elektron vericilerini kullanır, buna karşın fototrofik organzmalar onları sadece biyosentetik amaçla kullanırlar.
Solunum yapan organizmalar enerji kaynağı olarak kimyasal bileşikler kullanırlar, bunun için elektronlar bir yükseltgenme-indirgenme (redoks) tepkimesi ile indirgenmiş bir substrattan bir son elektron alıcısına taşınır. Bu tepkimenin açığa çıkardığı enerji ile ATP sentezlenir ve metabolizma yürütülür. Aerobik organizmalarda oksijen elektron alıcısı olarak kullanılır. Anaerobik organizmalarda nitrat, sülfat veya karbon dioksit gibi başka inorganik bileşikler elektron alıcısı olarak kullanılır. Bunlar sonucunda ekolojide büyük önem taşıyan denitrifikasyon, sülfat indirgenmesi ve asetogenez süreçleri meydana gelir.
Kemotroflarda, bir elektron alıcısının yokluğu halinde, bir diğer olası yaşam yolu fermantasyondur, bunda indirgenmiş substratlardan elde edilen elektronlar yükseltgenmiş ara ürünlere aktarılarak fermantasyon ürünleri meydana getirir, örneğin laktik asit, etanol, hidrojen, butirik asit gibi. Substratların enerji seviyesi ürünlerinkinden daha yüksek olması sayesinde fermantasyon mümkün olur, böylece organizmalar ATP sentezler ve metabolizmalarını çalıştırırlar.[89][90]
Bu süreçler, çevre kirlenmesine neden olan biyolojik tepkilerde de önemlidirler: örneğin sülfat indirgeyici bakteriler, cıvanın çok toksik şekillerinin (metil- ve dimetil-cıva) üretiminden büyük ölçüde sorumludur[91] Solunum yapmayan anaeroblar fermantasyon yoluyla enerji üretip indirgeyici güç elde ederler, bu sırada metabolik yan ürünleri (biracılıkta etanol gibi) atık olarak salgılarlar. Seçmeli anaeroblar (fakültatif anaeroblar), içinde bulundukları çevresel şartlara göre fermantasyon ile farklı elektron alıcıları arasında seçim yaparlar.
Litotrofik bakteriler enerji kaynağı olarak inorganik bileşikler kullanırlar. Yaygın kullanılan elektron vericileri hidrojen, karbon monoksit, amonyak (nitrifikasyona yol açar), feröz demir ve diğer indirgenmiş metal iyonları ve bazı indirgenmiş kükürt bileşikleridir. Metan gazı metanotrofik bakteriler tarafından hem bir elektron kaynağı hem de karbon anabolizmasında bir substrat olarak kullanılması bakımından dikkat çekicidir.[92] Hem aerobik fototrofi hem de kemolitotrofide, oksijen nihai elektron alıcısı olarak kullanılır, anaerobik şarlarda ise inorganik bileşikler kullanılır. Çoğu litotrofik organizma otortorfiktir, buna karşın organotrofik organzmalar heterotrofiktir.
Karbon dioksitin fotosentezle fiksasyonuna ek olarak bazı bakteriler, nitrojenaz enzimini kullanarak azot gazını sabitlerler (azot fiksasyonu). Çevresel olarak önemli olan bu özellik, yukarıda sayılmış metabolik tiplerin her birindeki bazı bakterilerde görülür ama evrensel değildir.[93]
Büyüme ve üreme
[değiştir | kaynağı değiştir]Çok hücreli organizmalardan farklı olarak, tek hücreli organizmalarda büyüme (hücre büyümesi) ve hücre bölünmesi yoluyla üreme sıkı bir şekilde birbirine bağlıdır. Bakteriler belli bir boya kadar büyür ve sonra eşeysiz üreme şekli olan ikili bölünme ile ürerler.[94] En iyi şartlarda bakteriler büyük bir hızla büyür ve ürerler; bakteri topluluklarının sayısı her 9,8 dakikada ikiye katlanabilir.[95] Hücre bölünmesinde birbirinin aynı iki yavru hücre meydana gelir. Bazı bakteriler, eşeysiz üremelerine rağmen, daha karmaşık yapılar oluşturur, bunlar yavru hücrelerin yayılmasını kolaylaştırır. Buna örnek miksobakteri'lerde tohum yapıları ve Streptomyces'te hif oluşumudur. Bazı bakterilerde ise tomurcuklanma olur, hücre yüzeyindeki meydana gelen bir uzantı kopunca bir yavru hücre meydana gelir.

Laboratuvarda bakteriler çoğu zaman katı veya sıvı ortamda büyütülürler. Katı büyüme ortamı olarak agar plakası kullanılır, bunlar aracılığıyla bir bakteri suşunun saf bir kültürü elde edilir. Ancak, büyümenin hızının ölçülmesi veya büyük miktarda hücrenin eldesi gerektiğinde sıvı büyüme ortamları kullanılır. Karıştırılan bir ortam içinde büyüyen bakteriler homojen bir hücre süspansiyonu olştururlar, böylece kültürün eşit olarak bölünmesi ve başka kaplara aktarımı kolay olur. Ancak sıvı ortamda tek bakteri hücrelerinini izole edilmesi zordur. Seçici ortam (belli besin maddeleri eklenmiş veya eksik bırakılmış veya antibiyotik eklenmiş ortam) belli organizmaların kimliğinin tespitine yardımcı olur.[97]
Bakteri büyütmek için kullanılan çoğu laboratuvar tekniğinde, çok miktarda hücrenin hızlı ve ucuz olarak üretilmesi için bol miktarda besinler kullanılır. Ancak, doğal ortamlarda besinler sınırlı miktradadır, bu yüzden bakteriler ilelebet üremeye devam edemez. Besin sınırlaması farklı büyüme stratejilerinin evrimleşmesine yol açar (bakınız: r/K seçilim teorisi. Bazı organizmalar besinler mevcut olunca son derece hızlı çoğalır, örneğin yaz aylarında bazı göllerde yosun ve siyanobakteriyel büyümelerinde olduğu gibi.[98] Başka bazı organizmalar sert çevresel şartlara adaptasyonları vardır, örneğin Streptomyces'in rakip organizmaları engellemek için çoklu antibiyotik salgılaması gibi.[99] Doğada çoğu organizma besin teminini kolaylaştıran ve çevresel streslere karşı koruyucu topluluklar halinde (biyofilm gibi) yaşar.[100] Bu ilişkiler belli canlı veya canlı gruplarının büyümesi için şart olabilir (sintrofi).
Bakteriyel büyüme üç evre izler. Bir bakteri topluluğu yüksek besin bulunduran bir ortama ilk girdiğinde hücrelerin yeni ortamlarına adapte olmaları gerekir. Büyümenin ilk evresi bekleme aşamasıdır (latent dönem veya lag fazı), bu yavaş büyüme döneminde hücreler yüksek besili ortama adapte olup hızlı büyümeye hazırlanırlar. Hızlı büyüme için gerekli olan proteinler üretilmekte olduğu için bekleme döneminde biyosentez hızı yüksektir.[101] Büyümenin ikinci evresi logaritmik faz (log fazı) veya üssel faz olarak adlandırılır. Bu evrede üssel büyüme olur. Bu evrede hücrelerin büyüme hızı (k), hücre sayısının iki katına çıkma süresi de jenerasyon zamanı (g) olarak adlandırılır. Besinlerden biri tükenip sınırlayıcı olana kadar süren log fazı sırasında besinler en yüksek hızla metabolize olur. Büyümenin son evresi durağan faz olarak adlandırılır ve besinlerin tükenmiş olmasından kaynaklanır. Hücreler metabolik etkinliklerini azaltır ve gerekli olmayan hücresel proteinlerini harcarlar. Durağan faz, hızlı büyümeden bir strese tepki haline geçiş dönemidir, DNA tamiri, antioksidan metabolizması ve besin taşıması ile ilişkili genlerin ifadesinde bir artış olur.[102]
Genetik
[değiştir | kaynağı değiştir]Çoğu bakteride tek bir dairesel kromozom bulunur, bunun büyüklüğü endosimbiyotik bir bakteri olan Candidatus Carsonella ruddii de 160.000 baz çiftinden,[103] bir toprak bakterisi olan Sorangium cellulosumda 12,200,000 baz çiftine kadar uzanır.[104] Borrelia cinsine ait spiroketler bu genel özelliğin bir istisnasıdır, Borrelia burgdorferi (Lyme hastalığı etmeni) gibi türlerde tek bir doğrusal kromozom bulunur.[105] Bakteriyel kromozomlardaki genler genelde tek bir sürekli DNA parçasından oluşur, bazı bakterilerde intronlar bulunmuşsa da bunlar ökaryotlarda olduğundan çok daha enderdir.[106]
Bakteriler aynı zamanda plazmidler de bulunabilir, bunlar kromozomdan ayrı DNA parçalarıdır, antibiyotik direnç genleri veya virülans faktörleri içerebilirler. Bir diğer tip bakteriyel DNA, kromozoma entegre olmuş virüslere (bakteriyofajlara) aittir. Çeşitli bakteriyofaj türleri vardır, bazıları sadece konak bakterilerini enfekte edip onu parçalar, diğerleri ise hücre içine girdikten sonra DNA'larını bakteriyel kromozoma dahil ederler. Bir bakteriyofaj konak hücresinini fenotipine katkıda bulunan genler taşıyabilir: örneğin Escherichia coli O157:H7'nin evrimi sırasında entegre olmuş bir fajın toksin genleri, zararsız bir atasal bakteriyi ölümcül bir patojene dönüştürmüştür.[107]
Bakteriler, eşeysiz organizmalar olarak, ana hücrelerinin genlerinin kopyalarını devralırlar. Ancak tüm bakteriler, DNA'larındaki değişikliklerin (mutasyon ve genetik rekombinasyonun) seçilimi ile evrimleşir. Mutasyonlar DNA ikileşmesi sırasında meydana gelen hatalar veya mutajenlerden kaynaklanır. Mutasyon hızları farklı bakteri türleri ve hatta aynı bakterinin farklı suşları arasında büyük farklılıklar gösterir.[108]
Bazı bakteriler ayrıca genetik malzemelerini hücreler arasında aktarabilirler. Bu üç yolla meydana gelebilir. Birincisi, bakteriler ortamlarıdaki yabancı DNA'yı içlerine alabilirler, buna transformasyon denir. Genler ayrıca transdüksiyon yoluyla, bir bakteriyofajın yabancı bir DNA parçasını kromozomun içine yerleştirmesiyle aktarılabilir. Gen aktarımını üçüncü yolu bakteriyel konjügasyondur, bunda DNA doğrudan hücresel temas yoluyla aktarılır. Başka bakteri veya ortamdan gen edinimine yatay gen transferi denir ve doğal şartlarda bu yaygın olabilir.[109] Gen transferi özellikle antibiyotik direncinin oluşmasında önemlidir, çünkü bu, farklı patojenler arasında direnç genlerinin transferini sağlar.[110]
Hareket
[değiştir | kaynağı değiştir]Hareketli (motil) bakteriler Kamçı, bakteriyel kayma, seğirmeli hareket ve batmazlık (buoyuans) değişmesi yoluyla hareket ederler.[111] Seğirmeli hareketlilikte bakteriler tip IV piluslarını bir kanca olarak kullanır, tekrar tekrar onu uzatır, bir yere saplar ve büyük bir kuvvetle (>80 pN) geri çeker.[112]

Bakteriyel türler kamçılarının sayı ve düzenine göre farklılık gösterirler; bazılarının tek bir kamçısı vardır (tek kamçılı veya monotrik), bazılarının iki uçta birer kamçısı (iki kamçılı veya amfitrik), bazılarının uçlarında kamçı kümeleri (iki demet kamçılı veya lofotrik), diğerlerinin ise tüm yüzeylerine yayılmış kamçıları vardır (çok kamçılı veya peritrik). Bakteri kamçısı yapısı en iyi anlaşılmış hareketlilik yapısıdır, 20 proteinden oluşur, ayrıca onun düzenlenmesi ve inşası için yaklaşık 30 diğer protein gereklidir.[111] Kamçının tabanında bulunan motor, membranın iki yanı arasındaki elektrokimyasal gradyanı güç için kullanır. Bu motor, bir pervane gibi çalışan iplikçiği döndürür.
Çoğu bakterinin (E. coli gibi) iki farklı hareket biçimi vardır: ileri hareket (yüzme) ve yuvarlanma (tumbling). Yuvarlanma sayesinde bakteri yönünü değiştirir ve izlediği yol üç boyutlu bir rassal yürüyüş şeklini alır[113] (Aşağıda verilen dış bağlantılarda ilgili videoya bakınız) Spiroketlerin kamçısı periplamik boşlukta iki zar arasında bulunur. Bu bakterilerin kendilerine has sarmal bir gövdeleri vardır ve hareket ederken kıvrılırlar.
Hareketli bakteriler belli uyaranlar tarafından çekim veya itime uğrarlar, bunun neden olduğu davranışlara taksis denir: bunların arasında kemotaksis, fototaksis ve manyetotaksis bulunur.[114][115] Myxobacterialerde, bireysel bakteriler beraber hareket ederek hücre dalgaları oluşturur, bunlar farklılaşıp içinde sporlar bulunduran tohum yapıları oluşturur.[116] myxobacteria'lar yalnızca katı ortam üzerindeyken hareket ederler, buna karşın E. coli hem sıvı hem katı ortamda hareketlidir.
Birkaç Listeria ve Shigella türü, konak hücreler içinde hareket ederken, normalde organellerin hücre içinde taşınmasını sağlayan hücre iskeletini kullanırlar. Kendi hücrelerinin bir kutbunda aktin polimerizasyonunu sağlayarak bir cins kuyruk oluştururlar, bu onları konak hücre sitoplazması içinde iter.[117]
Sınıflandırma ve kimlik tespiti
[değiştir | kaynağı değiştir]
Sınıflandırma, bakterileri benzerliklerine göre gruplandırıp adlandırarak onlardaki çeşitliliği betimlemeye yarar. Bakteriler hücre yapısı, hücresel metabolizma veya hücresel bileşenlerindeki (DNA, yağ asitleri, pigment, antijen ve kinonlar gibi) farklılıklara göre sınıflandırılabilirler.[97] Bu yöntemler bakteri suşlarının kimliklerinin tespitini ve sınıflandırılmasına olanak sağlasa da, bu farklılıkların farklı türler arasındaki varyasyonları mı yoksa aynı tür içindeki varyasyonları mı yansıttığı belli değildi. Bu belirsizliğin nedeni, çoğu bakteride ayırdedici yapıların olmaması, ayrıca birbiriyle ilişkisiz türler arasında yatay gen transferi olmasıydı.[118] Yatay gen trasnferi yüzünden birbirine akraba sayılabilecek bazı bakteri türleri çok farklı morfoloji ve metabolizmaya sahip olabilirler. Bu belirsizliğin üstesinden gelebilmek için modern bakteri sınıflandırması moleküler sistematiğe ağırlık verir, guanin sitozin oranının ölçümü, genom-genom hibridizasyonu, ayrıca yatay gen transferine uğramamış genlerin (ribozomal RNA gibi) dizilenmesi gibi genetik teknikler kullanır.[119] Bakteri sınıflandırması International Journal of Systematic Bacteriology[120] (uluslararası Sistematik Biyoloji) dergisi ve Bergey's Manual of Systematic Bacteriology[121] kitapçığında yayımlanarak resmîleşir.
"Bakteri" terimi bir zamanlar tüm mikroskopik, tek hücreli prokaryotlar için kullanılırdı. Ancak moleküler sistematik sayesinde prokaryotik yaşamın iki ayrı sahadan oluştuğu gösterildi. Önceleri Eubacteria ve Archaebacteria diye adlandırılan, ama artık Bacteria and Archaea olarak adlandırılan bu iki canlı grubu, ortak bir atadan ayrı ayrı evrimleşmişlerdir.[10] Arkeler ve ökaryotlar arasındaki yakınlık, her birinin bakterilerle olan yakınlığından daha çoktur. Bu iki saha (üst alem), Eukarya ile birlikte, günümüzde mikrobiyolojide en yaygın kullanılan sınıflandırma sistemi olan üç saha sisteminin temelini oluşturur.[122] Ancak, moleküler sistematiğin yakın zamanda kullanıma girmesi ve genom dizileri elde edilmiş canlıların sayısındaki hızlı artış nedeniyle bakteri sınıflandırması hâlen hızle değişen ve gelişen bir bilim dalıdır.[6][123] Örneğin, bazı biyologlar arke ve ökaryotların Gram-pozitif bakterilerden evrimleştiğini iddia etmektedirler.[124]
Laboratuvarda bakteri kimlik tespiti özellikle tıpta çok önemlidir, çünkü doğru tedavi, enfeksiyona yol açan bakteri türüne bağlıdır. Dolayısıyla insan patojenlerinin kimliğinin tespiti, bakterilerin tanımlanma tekniklerinin gelişmesinin başlıca dürtüsü olmuştur.
1884'te Hans Christian Gram tarafından geliştirilmiş Gram boyama, bakterileri hücre duvarlarının yapısal özelliklerine göre tanımlamakta kullanılır. Bazı organizmalar Gram boyasından başka boyalarla en iyi tanınabilirler. Özellikle mikobakteriler ve Nocardia Ziehl-Neelsen ve benzeri boyalarla asit eşliğinde boyanır.[126] Başka organizmalar özel ortamlarda büyümeleriyle tanınırlar veya seroloji gib başka teknikleri gerektirirler.
Kültür teknikleri, bakterilerin büyümesini sağlamak ve belli bakterilerin kimliğini tespit etmek, aynı zamanda da nümenede bulunan başka bakterilerin büyümesini sınırlamak için tasarlanmıştır. Çoğu zaman bu teknikler belli nümune türleri göz önüne alınarak geliştirilmiştir; örneğin bir tükürük örneği pnömoniye yol açan organizmaları ortaya çıkaracak şekilde işlemden geçirilir, bir dışkı örneği ise ishale yol açan organizalar tanımak için seçici ortamda kültürlenir, bu ortamda patojen olmayan bakteriler büyümez. Normal olarak steril olan örnekler, örneğin kan, idrar veya omurilik sıvısı, tüm organizmaların büyümesini sağlayan şartlarda kültürlenir.[97][127] Patojen bir organizma izole edildikten sonra, morfolojisi, büyüme özellikleri (aerobik veya anaerobik büyüme, hemoliz şekilleri gibi) ve boyama ile daha ayrıntılı olarak karakterize edilebilir.
Bakteri sınıflandırmasında olduğu gibi, bakteri kimlik tespiti de gittikçe daha sık olarak moleküler yöntemlerle yapılmaktadır. DNA'ya dayalı yöntemler, örneğin polimeraz zincir reaksiyonu, özgüllükleri ve çabuklukları nedeniyle, kültür yapmaya dayalı tekniklere kıyasla artarak popülerleşmektedir.[128] Bu yöntemler sayesinde "yaşayan ama kültürlenemeyen", yani metabolik olarak aktif olan ama bölünmeyen hücrelerin kimliklerini tespit etmek mümkün olmaktadır.[129] Ancak bu gelişmiş yöntemlerle dahi, bakteri türlerinin toplam sayısı bilinmemektedir ve bu sayı belli güven sınırları içinde tamin dahi edilememektedir. Mevcut sınıflandırmaya göre bilinen bakteri türlerinin (siyanobakteriler dahil) sayısı 9000'inin altındadır,[130] ama bakteriyel çeşitliliğin büyüklüğü hakkındaki tahminlerde toplam tür sayısı 107'den 109'a kadar uzanır ve hatta bu tahminlerin dahi birkaç büyüklük mertebesi kadar hatalı olabileceği düşünülmektedir.[131][132]
Diğer organizmalarla etkileşimler
[değiştir | kaynağı değiştir]Görünür basitliklerine rağmen, bakteriler diğer canlılarla karmaşık etkileşimler içindedir. Bu simbiyotik ilişkiler parazitizm, mutualizm ve komensalizm olarak üçe ayrılırlar. Komensal bakteriler her yerde bulunur, hayvan ve bitkiler üzerinde büyümeleri başka yüzeyler üzerinde büyümeleri ile aynıdır (ancak sıcaklık ve ter bunların büyümesini hızlandırabilir); insanlarda bu organizmalardan çok sayıda olması vücut kokusunun nedenidir.
Mutualistler
[değiştir | kaynağı değiştir]Bazı bakteriler varlıklarının devamı için gerekli olan, mekânsal olarak yakın ilişkilere girerler. Bu tür mutualist ilişkilerden biri olan türler arası hidrojen transferi olarak adlandırılır, butirik asit veya propiyonik asit tüketip hidrojen tüketen anaerobik bakteriler ile, hidrojen tüketen metanojenik arkeler arasındadır.[133] Bu ilişkide yer alan bakteriler kendi başlarına bu organik asitleri kullanamazlar çünkü bu reaksiyon sonucu aşığa çıkan hidrojen çevrelerinde birikir. Hidrojen tüketici arkelerle yakın ilişkileri sayesinde hidrojen konsantrasyonu yeterince düşük kalır ve bakteriler büyüyebilir.
Toprakta, rizosferde (kökün yüzeyi ve kökü bağlı olan topraktan oluşan bölgede) mikroorganizmalar azot fiksasyonu yaparlar, yani azot gazını azotlu bileşiklere dönüştürürler.[134] Bu süreç sonucunda bitkilerin (ki onlar azot fiksasyonu yapamazlar) kolayca absorbe edebildiği bir azot kaynağı meydana gelir. pek çok başka bakteri, insan ve başka canlılarda simbiont olarak bulunurlar. Örneğin normal insan bağırsağındaki bağırsak florasındaki 1000'den fazla bakteri, bağırsak bağışıklığına, bazı vitaminlerin (folik asit, K vitamini ve biyotin) sentezine, süt proteinlerinin laktik asite dönüştürülmesine (bkz. Laktobasiller) katkıda bulunur, ayrıca sindirilmemiş kompleks karbonhidratların fermantasyonunu sağlar.[135][136][137] Bu bağırsak floarası ayrıca potansiyle patojen bakterilerin büyümesini engellediği için (genelde rekabetçi dışlanım ilkesi ile) bu faydalı bakterilerin probiyotik besin katkısı olarak alınmasının olumlu etkileri bulunmuştur.[138]
Patojenler
[değiştir | kaynağı değiştir]
Eğer bakteriler başka organizmalarla parazitik ilişkiler kurarlarsa patojen olarak sınıflandırılırlar. Patojen bakteriler insanlarda ölüm ve hastalığın başlıca nedenidir; neden oldukları enfeksiyonlar arasında tetanos, tifo, tifüs, difteri, frengi, kolera, besin kaynaklı hastalıklar, cüzzam ve verem sayılabilir. Bilinen bir hastalığın patojenik kaynağının keşfi yıllar sürebilir, örneğin mide ülseri hastalığı ve Helicobacter pylori durumunda olduğu gibi. Bakteryel hastalıklar tarımda da önemlidir, bakteriler bitkilerde yaprak beneği, ateş yanıklığı ve solmaya, çiftlik hayvanlarında da paratüberküloz, mastit, salmonella ve şarbona neden olur.
Her patojen türün insan konağı ile etkileşimlerinin karakteristik bir spektrum oluşturur. Bazı organizmalar, örneğin Stafilokok veya Streptokok, deri enfeksiyonu, pnömoni, menenjit ve hatta sistemik sepsis (şok, masif vazodilatasyon ve ölümle sonuçlanan sistemik bir enflamasyon tepkisi) neden olur.[139] Lakin bu organizmalar aynı zamanda normal insan florasına aittir, genelde insan derisi ve burnunda bulunur ve hiçbir hastalığa yol açmazlar. Buna karşın bazı başka organizmalar her durumda insanda hastalık yaparlar. Örneği Rickettsia, ancak başka canlıların hücrelerinin içinde büyüyüp çoğalabilen, zorunlu bir hücre içi parazittir. Rickettsia'nin bir türü tifüse, bir diğeri ise Kayalık Dağlar benekli hummasına neden olur. Klamidya, zorunlu hücre içi paraziti bir diğer takımı içinde bulunan bazı türler pnömoni veya idrar yolu enfeksiyonuna neden olabilir, ayrıca koroner kalp hastalığı ile de ilişkili olabilirler.[140] Nihayet, bazı bakteri türleri, Pseudomonas aeruginosa, Burkholderia cenocepacia ve Mycobacterium avium gibi, fırsatçı patojendirler ve sadece immün yetmezlik çeken veya kistik fibrozlu kişilerde hastalık yaparlar.[141][142]
Bakteriyel enfeksiyonlar antibiyotikle tedavi edilebilirler, bu antibiyotikler bakterileri öldürürse bakteriosidal, sadece onların çoğalmasını engelliyorsa bakteriostatik olarak sınıflandırılır. Pek çok antibiyotik vardır ve bunların her sınıfı patojende olup konağında olmayan bir süreci engeller. Antibiyotiklerin nasıl seçici toksiklik gösterdiğine bir örneği kloramfenikol ve puromisindir, bunlar bakteri ribozomlarını engellerler, ama yapısal olarak farklı olan ökaryotik ribozomlara etki etmezler.[143] İnsan hastalıklarını tedavide kullanılan antibiyotiklerin hayvancılıkta da hayvanlarının büyümesini hızlandırmak için kullanılması, bakterilerde antibiyotik direnci gelişmesine neden olabilir.[144]
Enfeksiyonları engellemek için antiseptik önlemler alınır, örneğin deri bir iğne ile delinmeden evvel sterilize edilir. Cerrahi ve dişçilik araçları da kontaminasyon ve bakteriyel enfeksiyonu önlemek için sterilize edilir. Çamaşır suyu gibi dezenfektanlar, eşya yüzeylerinde bulunan bakteri ve diğer patojenleri öldürüp kontaminasyonu önlemek ve enfeksiyon riskini daha da azaltmak amacıyla kullanılır.
Teknoloji ve endüstride önemi
[değiştir | kaynağı değiştir]Bakteriler, çoğu zaman laktobasil türleri, maya ve küflerle beraber, fermante edilmiş gıdaların (peynir, turşu, soya sosu, sirke, şarap ve yoğurt gibi) hazırlanmasında binlerce yıldır kullanılmaktadır.[145][146]
Bakterilerin çeşitli organik bileşikleri parçalayabilme yetenekleri dikkate değerdir ve atıkların işlenmesi ve değerlendirilmesinde (bioremediation) kullanılmıştır. Petroldeki hidrokarbonları sindirebilen bakteriler çoğu zaman petrol sızıntılarının temizlenmesinde kullanılır.[147] 1989'da meydana gelen Exxon Valdez tanker kazasının ardından Prince William Sound kıyılarına gübre dökülerek bu doğal bakterilerin büyümesi teşvik edilmişti. Bu yöntem, çok fazla petrol kaplanmamış kıyılarda etkili olmuştu. Bakteriler ayrıca endüstriyel toksik atıkların değerlendirilmesinde de kullanılırlar.[148] Kimya endüstrisinde, enantiyomerik olarak saf kimyasalların üretilmesinde (bunlar ilaç ve tarımsal kimyasalların hammaddesidir) bakteriler önemli rol oynarlar.[149]
Bakteriler ayrıca biyolojik haşare kontrolünde haşare ilaçlarının yerine kullanılabilirler. Bunun en yaygın örneği, Gram pozitif bir toprak bakterisi olan Bacillus thuringiensisdir (BT olarak da adlandırılır). Bu bakterinin alt-türleri kelebeklere (Lepidoptera türlerine) özgül bir böcek öldürücü olarak kullanılır.[150] Spesifik olmalarından dolayı bu böcek öldürücüler çevre dostu olarak kabul edilir; insanlara, yabani hayvanlara, polinasyon yapan ve diğer faydalı böceklere etkileri çok az veya hiçtir.[151][152]
Hızlı büyüme ve kolaylıkla manipüle edilebilmelerinden dolayı bakteriler moleküler biyoloji, genetik ve biyokimyada birer araç olarak kullanılırlar. Bakteri DNA'sında mutasyon yapıp bunun fenotipini inceleyerek bilimciler genlerin, enzimlerin ve metabolik patikaların işlevlerini belirleyebilmekte, sonra edindikleri bilgileri daha karmaşık canlılara uygulayabilmektedirler.[153] Muazzam miktarda enzim kinetiği ve gen ifadesi verileri, canlıların matematiksel modellerinde kullanılarak hücrenin biyokimyasının anlanması amaçlanmaktadır. Çok çalışılmış bazı bakterilerde bu mümkündür, Escherichia coli metabolizmasının modelleri üretilmekte ve denenmektedir.[154][155] Bakteri metabolizması ve genetiğinin bu seviyede anlaşılır olması sayesinde bakterilerin biyoteknoloji kullanılarak yeniden tasarımı mümkün olmakta, böylece onların tedavi amaçlı proteinleri (insülin, büyüme faktörleri veya antikorlar gibi) daha verimli şekilde üretmesi sağlanabilmektedir.[156][157]
Ayrıca bakınız
[değiştir | kaynağı değiştir]Notlar
[değiştir | kaynağı değiştir]- ^ Pavan M.E. ve diğerleri. (Mayıs 2018). "Proposal for a new classification of a deep branching bacterial phylogenetic lineage: transfer of Coprothermobacter proteolyticus and Coprothermobacter platensis to Coprothermobacteraceae fam. nov., within Coprothermobacterales ord. nov., Coprothermobacteria classis nov. and Coprothermobacterota phyl. nov. and emended description of the family Thermodesulfobiaceae". Int. J. Syst. Evol. Microbiol., 5. ss. 1627-32. doi:10.1099/ijsem.0.002720. ISSN 1466-5026. PMID 29595416.
- ^ a b Woese C, Kandler O, Wheelis M (1990). "Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya". Proc Natl Acad Sci U S a. 87 (12). ss. 4576-4579. doi:10.1073/pnas.87.12.4576. PMID 2112744. 27 Haziran 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Kaynak hatası: Geçersiz
<ref>etiketi;Woese1977isimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ Fredrickson J, Zachara J, Balkwill D; ve diğerleri. (2004). "Geomicrobiology of high-level nuclear waste-contaminated vadose sediments at the Hanford site, Washington state". Appl Environ Microbiol. 70 (7). ss. 4230-41. doi:10.1128/AEM.70.7.4230-4241.2004. PMID 15240306. 29 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ a b Whitman W, Coleman D, Wiebe W (1998). "Prokaryotes: the unseen majority". Proc Natl Acad Sci U S a. 95 (12). ss. 6578-83. doi:10.1073/pnas.95.12.6578. PMID 9618454. 5 Mart 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ a b Rappé MS, Giovannoni SJ (2003). "The uncultured microbial majority". Annu. Rev. Microbiol. Cilt 57. ss. 369-94. doi:10.1146/annurev.micro.57.030502.090759. PMID 14527284.
- ^ Sears CL (2005). "A dynamic partnership: celebrating our gut flora". Anaerobe. 11 (5). ss. 247-51. doi:10.1016/j.anaerobe.2005.05.001. PMID 16701579.
- ^ "2002 WHO mortality data". 23 Ekim 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 20 Ocak 2007.
- ^ Ishige T, Honda K, Shimizu S (2005). "Whole organism biocatalysis". Curr Opin Chem Biol. 9 (2). ss. 174-80. doi:10.1016/j.cbpa.2005.02.001. PMID 15811802.
- ^ a b Woese C, Kandler O, Wheelis M (1990). "Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya". Proc Natl Acad Sci U S a. 87 (12). ss. 4576-9. doi:10.1073/pnas.87.12.4576. PMID 2112744. 27 Haziran 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Porter JR (1976). "Antony van Leeuwenhoek: Tercentenary of his discovery of bacteria". Bacteriological reviews. 40 (2). ss. 260-269. PMID 786250. 15 Eylül 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Ağustos 2007.
- ^ van Leeuwenhoek A (1684). "An abstract of a letter from Mr. Anthony Leevvenhoek at Delft, dated Sep. 17, 1683, Containing Some Microscopical Observations, about Animals in the Scurf of the Teeth, the Substance Call'd Worms in the Nose, the Cuticula Consisting of Scales". Philosophical Transactions (1683-1775). Cilt 14. ss. 568-574. Erişim tarihi: 19 Ağustos 2007.[ölü/kırık bağlantı]
- ^ van Leeuwenhoek A (1700). "Part of a Letter from Mr Antony van Leeuwenhoek, concerning the Worms in Sheeps Livers, Gnats, and Animalcula in the Excrements of Frogs". Philosophical Transactions (1683-1775). Cilt 22. ss. 509-518. Erişim tarihi: 19 Ağustos 2007.[ölü/kırık bağlantı]
- ^ van Leeuwenhoek A (1702). "Part of a Letter from Mr Antony van Leeuwenhoek, F. R. S. concerning Green Weeds Growing in Water, and Some Animalcula Found about Them". Philosophical Transactions (1683-1775). Cilt 23. ss. 1304-11. doi:10.1098/rstl.1702.0042. Erişim tarihi: 19 Ağustos 2007.[ölü/kırık bağlantı]
- ^ "Etymology of the word "bacteria"". Online Etymology dictionary. 21 Kasım 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2006.
- ^ "Pasteur's Papers on the Germ Theory". LSU Law Center's Medical and Public Health Law Site, Historic Public Health Articles. 29 Mart 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Kasım 2006.
- ^ "The Nobel Prize in Physiology or Medicine 1905". Nobelprize.org. 22 Nisan 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Kasım 2006.
- ^ O'Brien S, Goedert J (1996). "HIV causes AIDS: Koch's postulates fulfilled". Curr Opin Immunol. 8 (5). ss. 613-618. doi:10.1016/S0952-7915(96)80075-6. PMID 8902385.
- ^ Thurston A (2000). "Of blood, inflammation and gunshot wounds: the history of the control of sepsis". Aust N Z J Surg. 70 (12). ss. 855-61. doi:10.1046/j.1440-1622.2000.01983.x. PMID 11167573.
- ^ Schwartz R (2004). "Paul Ehrlich's magic bullets". N Engl J Med. 350 (11). ss. 1079-80. doi:10.1056/NEJMp048021. PMID 15014180.
- ^ "Biography of Paul Ehrlich". Nobelprize.org. 8 Aralık 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Kasım 2006.
- ^ Woese C, Fox G (1977). "Phylogenetic structure of the prokaryotic domain: the primary kingdoms". Proc Natl Acad Sci U S a. 74 (11). ss. 5088-5090. doi:10.1073/pnas.74.11.5088. PMID 270744.
- ^ Schopf J (1994). "Disparate rates, differing fates: tempo and mode of evolution changed from the Precambrian to the Phanerozoic". Proc Natl Acad Sci U S a. 91 (15). ss. 6735-42. doi:10.1073/pnas.91.15.6735. PMID 8041691. 12 Eylül 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 31 Ağustos 2008.
- ^ DeLong E, Pace N (2001). "Environmental diversity of bacteria and archaea". Syst Biol. 50 (4). ss. 470-78. doi:10.1080/106351501750435040. PMID 12116647.
- ^ Brown JR, Doolittle WF (1997). "Archaea and the prokaryote-to-eukaryote transition". Microbiol. Mol. Biol. Rev. 61 (4). ss. 456-502. PMID 9409149. 30 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Di Giulio M (2003). "The universal ancestor and the ancestor of bacteria were hyperthermophiles". J Mol Evol. 57 (6). ss. 721-30. doi:10.1007/s00239-003-2522-6. PMID 14745541.
- ^ Battistuzzi F, Feijao A, Hedges S (2004). "A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land". BMC Evol Biol. Cilt 4. s. 44. doi:10.1186/1471-2148-4-44. PMID 15535883. 30 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Poole A, Penny D (2007). "Evaluating hypotheses for the origin of eukaryotes". Bioessays. 29 (1). ss. 74-84. doi:10.1002/bies.20516. PMID 17187354.
- ^ Dyall S, Brown M, Johnson P (2004). "Ancient invasions: from endosymbionts to organelles". Science. 304 (5668). ss. 253-7. doi:10.1126/science.1094884. PMID 15073369.
- ^ Lang B, Gray M, Burger G (1999). "Mitochondrial genome evolution and the origin of eukaryotes". Annu Rev Genet. Cilt 33. ss. 351-97. doi:10.1146/annurev.genet.33.1.351. PMID 10690412.
- ^ McFadden G (1999). "Endosymbiosis and evolution of the plant cell". Curr Opin Plant Biol. 2 (6). ss. 513-9. doi:10.1016/s1369-5266(99)00025-4. PMID 10607659.
- ^ Schulz H, Jorgensen B (2001). "Big bacteria". Annu Rev Microbiol. Cilt 55. ss. 105-37. doi:10.1146/annurev.micro.55.1.105. PMID 11544351.
- ^ Robertson J, Gomersall M, Gill P. (1975). "Mycoplasma hominis: growth, reproduction, and isolation of small viable cells". J Bacteriol. 124 (2). ss. 1007-18. PMID 1102522.
- ^ Velimirov, B. (2001). "Nanobacteria, Ultramicrobacteria and Starvation Forms: A Search for the Smallest Metabolizing Bacterium". Microbes and Environments. 16 (2). ss. 67-77. doi:10.1264/jsme2.2001.67. 13 Ocak 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Haziran 2008.
- ^ Fritz I, Strömpl C, Abraham W (2004). "Phylogenetic relationships of the genera Stella, Labrys and Angulomicrobium within the 'Alphaproteobacteria' and description of Angulomicrobium amanitiforme sp. nov". Int J Syst Evol Microbiol. 54 (Pt 3). ss. 651-7. doi:10.1099/ijs.0.02746-0. PMID 15143003. 10 Ekim 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Wanger Onstott Southam (2008). "Stars of the terrestrial deep subsurface: A novel 'star-shaped' bacterial morphotype from a South African platinum mine". Geobiology. 6 (3). ss. 325-330. doi:10.1111/j.1472-4669.2008.00163.x.
- ^ Cabeen M, Jacobs-Wagner C (2005). "Bacterial cell shape". Nat Rev Microbiol. 3 (8). ss. 601-10. doi:10.1038/nrmicro1205. PMID 16012516.
- ^ Young K (2006). "The selective value of bacterial shape". Microbiol Mol Biol Rev. 70 (3). ss. 660-703. doi:10.1128/MMBR.00001-06. PMID 16959965.
- ^ Douwes K, Schmalzbauer E, Linde H, Reisberger E, Fleischer K, Lehn N, Landthaler M, Vogt T (2003). "Branched filaments no fungus, ovoid bodies no bacteria: Two unusual cases of mycetoma". J Am Acad Dermatol. 49 (2 Suppl Case Reports). ss. S170-3. doi:10.1067/mjd.2003.302. PMID 12894113.
- ^ Donlan R (2002). "Biofilms: microbial life on surfaces". Emerg Infect Dis. 8 (9). ss. 881-90. PMID 12194761.
- ^ Branda S, Vik S, Friedman L, Kolter R (2005). "Biofilms: the matrix revisited". Trends Microbiol. 13 (1). ss. 20-26. doi:10.1016/j.tim.2004.11.006. PMID 15639628.
- ^ Davey M, O'toole G (2000). "Microbial biofilms: from ecology to molecular genetics". Microbiol Mol Biol Rev. 64 (4). ss. 847-67. doi:10.1128/MMBR.64.4.847-867.2000. PMID 11104821.
- ^ Donlan RM, Costerton JW (2002). "Biofilms: survival mechanisms of clinically relevant microorganisms". Clin Microbiol Rev. 15 (2). ss. 167-93. doi:10.1128/CMR.15.2.167-193.2002. PMID 11932229.
- ^ Shimkets L (1999). "Intercellular signaling during fruiting-body development of Myxococcus xanthus". Annu Rev Microbiol. Cilt 53. ss. 525-49. doi:10.1146/annurev.micro.53.1.525. PMID 10547700.
- ^ Kaiser D (2004). "Signaling in myxobacteria". Annu Rev Microbiol. Cilt 58. ss. 75-98. doi:10.1146/annurev.micro.58.030603.123620. PMID 15487930.
- ^ Berg JM, Tymoczko JL Stryer L (2002). Molecular Cell Biology (5. ed. bas.). WH Freeman. ISBN 0-7167-4955-6.
- ^ Gitai Z (2005). "The new bacterial cell biology: moving parts and subcellular architecture". Cell. 120 (5). ss. 577-86. doi:10.1016/j.cell.2005.02.026. PMID 15766522.
- ^ Shih YL, Rothfield L (2006). "The bacterial cytoskeleton". Microbiol. Mol. Biol. Rev. 70 (3). ss. 729-54. doi:10.1128/MMBR.00017-06. PMID 16959967. 18 Ekim 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Gitai Z (Mart 2005). "The new bacterial cell biology: moving parts and subcellular architecture". Cell. 120 (5). ss. 577-86. doi:10.1016/j.cell.2005.02.026. PMID 15766522.
- ^ Kerfeld CA, Sawaya MR, Tanaka S; ve diğerleri. (Ağustos 2005). "Protein structures forming the shell of primitive bacterial organelles". Science (journal). 309 (5736). ss. 936-8. doi:10.1126/science.1113397. PMID 16081736.
- ^ Bobik, T. A. (2007). "Bacterial Microcompartments" (PDF). Microbe. Cilt 2. Am Soc Microbiol. ss. 25-31. 2 Ağustos 2008 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Bobik, T. A. (2006). "Polyhedral organelles compartmenting bacterial metabolic processes" (PDF). Applied Microbiology and Biotechnology. 70 (5). ss. 517-525. doi:10.1007/s00253-005-0295-0.[ölü/kırık bağlantı]
- ^ Harold F (1972). "Conservation and transformation of energy by bacterial membranes". Bacteriol Rev. 36 (2). ss. 172-230. PMID 4261111.[ölü/kırık bağlantı]
- ^ Bryant DA, Frigaard NU (2006). "Prokaryotic photosynthesis and phototrophy illuminated". Trends Microbiol. 14 (11). s. 488. doi:10.1016/j.tim.2006.09.001.
- ^ Psencík J, Ikonen TP, Laurinmäki P; ve diğerleri. (Ağustos 2004). "Lamellar organization of pigments in chlorosomes, the light harvesting complexes of green photosynthetic bacteria". Biophys. J. 87 (2). ss. 1165-72. doi:10.1529/biophysj.104.040956. PMC 1304455 $2. PMID 15298919. 10 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Tanaka S, Kerfeld CA, Sawaya MR; ve diğerleri. (Şubat 2008). "Atomic-level models of the bacterial carboxysome shell". Science (journal). 319 (5866). ss. 1083-6. doi:10.1126/science.1151458. PMID 18292340.
- ^ Thanbichler M, Wang S, Shapiro L (2005). "The bacterial nucleoid: a highly organized and dynamic structure". J Cell Biochem. 96 (3). ss. 506-21. doi:10.1002/jcb.20519. PMID 15988757.
- ^ Fuerst J (2005). "Intracellular compartmentation in planctomycetes". Annu Rev Microbiol. Cilt 59. ss. 299-328. doi:10.1146/annurev.micro.59.030804.121258. PMID 15910279.
- ^ Poehlsgaard J, Douthwaite S (2005). "The bacterial ribosome as a target for antibiotics". Nat Rev Microbiol. 3 (11). ss. 870-81. doi:10.1038/nrmicro1265. PMID 16261170.
- ^ Yeo M, Chater K (2005). "The interplay of glycogen metabolism and differentiation provides an insight into the developmental biology of Streptomyces coelicolor". Microbiology. 151 (Pt 3). ss. 855-61. doi:10.1099/mic.0.27428-0. PMID 15758231. 11 Mayıs 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Shiba T, Tsutsumi K, Ishige K, Noguchi T (2000). "Inorganic polyphosphate and polyphosphate kinase: their novel biological functions and applications". Biochemistry (Mosc). 65 (3). ss. 315-23. PMID 10739474. 14 Ekim 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Brune DC. (1995). "Isolation and characterization of sulfur globule proteins from Chromatium vinosum and Thiocapsa roseopersicina". Arch Microbiol. 163 (6). ss. 391-99. doi:10.1007/BF00272127. PMID 7575095. 12 Mayıs 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Kadouri D, Jurkevitch E, Okon Y, Castro-Sowinski S. (2005). "Ecological and agricultural significance of bacterial polyhydroxyalkanoates". Crit Rev Microbiol. 31 (2). ss. 55-67. doi:10.1080/10408410590899228. PMID 15986831. 26 Nisan 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Walsby A (1994). "Gas vesicles". Microbiol Rev. 58 (1). ss. 94-144. PMID 8177173.[ölü/kırık bağlantı]
- ^ van Heijenoort J (2001). "Formation of the glycan chains in the synthesis of bacterial peptidoglycan". Glycobiology. 11 (3). ss. 25R-36R. doi:10.1093/glycob/11.3.25R. PMID 11320055. 1 Temmuz 2009 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ a b Koch A (2003). "Bacterial wall as target for attack: past, present, and future research". Clin Microbiol Rev. 16 (4). ss. 673-87. doi:10.1128/CMR.16.4.673-687.2003. PMID 14557293. 28 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Gram, HC (1884). "Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten". Fortschr. Med. Cilt 2. ss. 185-189.
- ^ Hugenholtz P (2002). "Exploring prokaryotic diversity in the genomic era". Genome Biology. 3 (2). ss. REVIEWS0003. doi:10.1186/gb-2002-3-2-reviews0003. PMID 11864374. 13 Eylül 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Walsh F, Amyes S (2004). "Microbiology and drug resistance mechanisms of fully resistant pathogens". Curr Opin Microbiol. 7 (5). ss. 439-44. doi:10.1016/j.mib.2004.08.007. PMID 15451497.
- ^ Engelhardt H, Peters J (1998). "Structural research on surface layers: a focus on stability, surface layer homology domains, and surface layer-cell wall interactions". J Struct Biol. 124 (2-3). ss. 276-302. doi:10.1006/jsbi.1998.4070. PMID 10049812.
- ^ Beveridge T, Pouwels P, Sára M, Kotiranta A, Lounatmaa K, Kari K, Kerosuo E, Haapasalo M, Egelseer E, Schocher I, Sleytr U, Morelli L, Callegari M, Nomellini J, Bingle W, Smit J, Leibovitz E, Lemaire M, Miras I, Salamitou S, Béguin P, Ohayon H, Gounon P, Matuschek M, Koval S (1997). "Functions of S-layers". FEMS Microbiol Rev. 20 (1-2). ss. 99-149. PMID 9276929.
- ^ Kojima S, Blair D (2004). "The bacterial flagellar motor: structure and function of a complex molecular machine". Int Rev Cytol. Cilt 233. ss. 93-134. doi:10.1016/S0074-7696(04)33003-2. PMID 15037363.
- ^ Beachey E (1981). "Bacterial adherence: adhesin-receptor interactions mediating the attachment of bacteria to mucosal surface". J Infect Dis. 143 (3). ss. 325-45. PMID 7014727.
- ^ Silverman P (1997). "Towards a structural biology of bacterial conjugation". Mol Microbiol. 23 (3). ss. 423-9. doi:10.1046/j.1365-2958.1997.2411604.x. PMID 9044277.
- ^ Stokes R, Norris-Jones R, Brooks D, Beveridge T, Doxsee D, Thorson L (2004). "The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages". Infect Immun. 72 (10). ss. 5676-86. doi:10.1128/IAI.72.10.5676-5686.2004. PMID 15385466. 29 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Daffé M, Etienne G (1999). "The capsule of Mycobacterium tuberculosis and its implications for pathogenicity". Tuber Lung Dis. 79 (3). ss. 153-69. doi:10.1054/tuld.1998.0200. PMID 10656114.
- ^ Finlay B, Falkow S (1997). "Common themes in microbial pathogenicity revisited". Microbiol Mol Biol Rev. 61 (2). ss. 136-69. PMID 9184008.[ölü/kırık bağlantı]
- ^ Nicholson W, Munakata N, Horneck G, Melosh H, Setlow P (2000). "Resistance of Bacillus endospores to extreme terrestrial and extraterrestrial environments". Microbiol Mol Biol Rev. 64 (3). ss. 548-72. doi:10.1128/MMBR.64.3.548-572.2000. PMID 10974126.[ölü/kırık bağlantı]
- ^ Siunov A, Nikitin D, Suzina N, Dmitriev V, Kuzmin N, Duda V. "Phylogenetic status of Anaerobacter polyendosporus, an anaerobic, polysporogenic bacterium" (PDF). Int J Syst Bacteriol. Cilt 49 Pt 3. ss. 1119-24. PMID 10425769. 16 Haziran 2007 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Nicholson W, Fajardo-Cavazos P, Rebeil R, Slieman T, Riesenman P, Law J, Xue Y (2002). "Bacterial endospores and their significance in stress resistance". Antonie Van Leeuwenhoek. 81 (1-4). ss. 27-32. doi:10.1023/A:1020561122764. PMID 12448702.
- ^ Vreeland R, Rosenzweig W, Powers D (2000). "Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal". Nature. 407 (6806). ss. 897-900. doi:10.1038/35038060. PMID 11057666.
- ^ Cano R, Borucki M (1995). "Revival and identification of bacterial spores in 25- to 40-million-year-old Dominican amber". Science. 268 (5213). ss. 1060-4. doi:10.1126/science.7538699. PMID 7538699.
- ^ Nicholson W, Schuerger A, Setlow P (2005). "The solar UV environment and bacterial spore UV resistance: considerations for Earth-to-Mars transport by natural processes and human spaceflight". Mutat Res. 571 (1-2). ss. 249-64. PMID 15748651.
- ^ Hatheway C (1990). "Toxigenic clostridia". Clin Microbiol Rev. 3 (1). ss. 66-98. PMID 2404569.[ölü/kırık bağlantı]
- ^ Nealson K (1999). "Post-Viking microbiology: new approaches, new data, new insights". Orig Life Evol Biosph. 29 (1). ss. 73-93. doi:10.1023/A:1006515817767. PMID 11536899.
- ^ Xu J (2006). "Microbial ecology in the age of genomics and metagenomics: concepts, tools, and recent advances". Mol Ecol. 15 (7). ss. 1713-31. doi:10.1111/j.1365-294X.2006.02882.x. PMID 16689892.
- ^ Zillig W (1991). "Comparative biochemistry of Archaea and Bacteria". Curr Opin Genet Dev. 1 (4). ss. 544-51. doi:10.1016/S0959-437X(05)80206-0. PMID 1822288.
- ^ Hellingwerf K, Crielaard W, Hoff W, Matthijs H, Mur L, van Rotterdam B (1994). "Photobiology of bacteria". Antonie Van Leeuwenhoek. 65 (4). ss. 331-47. doi:10.1007/BF00872217. PMID 7832590.
- ^ Zumft W (1997). "Cell biology and molecular basis of denitrification". Microbiol Mol Biol Rev. 61 (4). ss. 533-616. PMID 9409151. 29 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Drake H, Daniel S, Küsel K, Matthies C, Kuhner C, Braus-Stromeyer S (1997). "Acetogenic bacteria: what are the in situ consequences of their diverse metabolic versatilities?". Biofactors. 6 (1). ss. 13-24. PMID 9233536.
- ^ Morel, FMM (1998). "The chemical cycle and bioaccumulation of mercury". Annual Review of Ecological Systems. Cilt 29. ss. 543-566. doi:10.1146/annurev.ecolsys.29.1.543.
- ^ Dalton H (2005). "The Leeuwenhoek Lecture 2000 the natural and unnatural history of methane-oxidizing bacteria". Philos Trans R Soc Lond B Biol Sci. 360 (1458). ss. 1207-22. doi:10.1098/rstb.2005.1657. PMID 16147517. 1 Nisan 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Zehr J, Jenkins B, Short S, Steward G (2003). "Nitrogenase gene diversity and microbial community structure: a cross-system comparison". Environ Microbiol. 5 (7). ss. 539-54. doi:10.1046/j.1462-2920.2003.00451.x. PMID 12823187.
- ^ Koch A (2002). "Control of the bacterial cell cycle by cytoplasmic growth". Crit Rev Microbiol. 28 (1). ss. 61-77. doi:10.1080/1040-840291046696. PMID 12003041.
- ^ Eagon R. "Pseudomonas natriegens, a marine bacterium with a generation time of less than 10 minutes". J Bacteriol. Cilt 83. ss. 736-7. PMID 13888946.[ölü/kırık bağlantı]
- ^ Stewart EJ, Madden R, Paul G, Taddei F (2005). "Aging and death in an organism that reproduces by morphologically symmetric division". PLoS Biol. 3 (2). ss. e45. doi:10.1371/journal.pbio.0030045. PMID 15685293.
- ^ a b c Thomson R, Bertram H (2001). "Laboratory diagnosis of central nervous system infections". Infect Dis Clin North Am. 15 (4). ss. 1047-71. doi:10.1016/S0891-5520(05)70186-0. PMID 11780267.
- ^ Paerl H, Fulton R, Moisander P, Dyble J (2001). "Harmful freshwater algal blooms, with an emphasis on cyanobacteria". ScientificWorldJournal. Cilt 1. ss. 76-113. doi:10.1100/tsw.2001.16. PMID 12805693.
- ^ Challis G, Hopwood D (2003). "Synergy and contingency as driving forces for the evolution of multiple secondary metabolite production by Streptomyces species". Proc Natl Acad Sci U S a. Cilt 100 Suppl 2. ss. 14555-61. doi:10.1073/pnas.1934677100. PMID 12970466. 25 Temmuz 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Kooijman S, Auger P, Poggiale J, Kooi B (2003). "Quantitative steps in symbiogenesis and the evolution of homeostasis". Biol Rev Camb Philos Soc. 78 (3). ss. 435-63. doi:10.1017/S1464793102006127. PMID 14558592.
- ^ Prats C, López D, Giró A, Ferrer J, Valls J (2006). "Individual-based modelling of bacterial cultures to study the microscopic causes of the lag phase". J Theor Biol. 241 (4). ss. 939-53. PMID 16524598.
- ^ Hecker M, Völker U (2001). "General stress response of Bacillus subtilis and other bacteria". Adv Microb Physiol. Cilt 44. ss. 35-91. doi:10.1016/S0065-2911(01)44011-2. PMID 11407115.
- ^ Nakabachi A, Yamashita A, Toh H, Ishikawa H, Dunbar H, Moran N, Hattori M (2006). "The 160-kilobase genome of the bacterial endosymbiont Carsonella". Science. 314 (5797). s. 267. doi:10.1126/science.1134196. PMID 17038615.
- ^ Pradella S, Hans A, Spröer C, Reichenbach H, Gerth K, Beyer S (2002). "Characterisation, genome size and genetic manipulation of the myxobacterium Sorangium cellulosum So ce56". Arch Microbiol. 178 (6). ss. 484-92. doi:10.1007/s00203-002-0479-2. PMID 12420170.
- ^ Hinnebusch J, Tilly K (1993). "Linear plasmids and chromosomes in bacteria". Mol Microbiol. 10 (5). ss. 917-22. doi:10.1111/j.1365-2958.1993.tb00963.x. PMID 7934868.
- ^ Belfort M, Reaban ME, Coetzee T, Dalgaard JZ (1995). "Prokaryotic introns and inteins: a panoply of form and function". J. Bacteriol. 177 (14). ss. 3897-903. PMID 7608058. 30 Mayıs 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Brüssow H, Canchaya C, Hardt W (2004). "Phages and the evolution of bacterial pathogens: from genomic rearrangements to lysogenic conversion". Microbiol Mol Biol Rev. 68 (3). ss. 560-602. doi:10.1128/MMBR.68.3.560-602.2004. PMID 15353570.[ölü/kırık bağlantı]
- ^ Denamur E, Matic I (2006). "Evolution of mutation rates in bacteria". Mol Microbiol. 60 (4). ss. 820-7. doi:10.1111/j.1365-2958.2006.05150.x. PMID 16677295.
- ^ Davison J (1999). "Genetic exchange between bacteria in the environment". Plasmid. 42 (2). ss. 73-91. doi:10.1006/plas.1999.1421. PMID 10489325.
- ^ Hastings P, Rosenberg S, Slack A (2004). "Antibiotic-induced lateral transfer of antibiotic resistance". Trends Microbiol. 12 (9). ss. 401-4. doi:10.1016/j.tim.2004.07.003. PMID 15337159.
- ^ a b Bardy S, Ng S, Jarrell K (2003). "Prokaryotic motility structures". Microbiology. 149 (Pt 2). ss. 295-304. doi:10.1099/mic.0.25948-0. PMID 12624192. 14 Eylül 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Merz A, So M, Sheetz M (2000). "Pilus retraction powers bacterial twitching motility". Nature. 407 (6800). ss. 98-102. doi:10.1038/35024105. PMID 10993081.
- ^ Wu M, Roberts J, Kim S, Koch D, DeLisa M (2006). "Collective bacterial dynamics revealed using a three-dimensional population-scale defocused particle tracking technique". Appl Environ Microbiol. 72 (7). ss. 4987-94. doi:10.1128/AEM.00158-06. PMID 16820497. 29 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Lux R, Shi W (2004). "Chemotaxis-guided movements in bacteria". Crit Rev Oral Biol Med. 15 (4). ss. 207-20. PMID 15284186.
- ^ Frankel R, Bazylinski D, Johnson M, Taylor B (1997). "Magneto-aerotaxis in marine coccoid bacteria". Biophys J. 73 (2). ss. 994-1000. PMID 9251816.
- ^ Kaiser D (2004). "Signaling in myxobacteria". Annu Rev Microbiol. Cilt 58. ss. 75-98. doi:10.1146/annurev.micro.58.030603.123620. PMID 15487930.
- ^ Goldberg MB (2001). "Actin-based motility of intracellular microbial pathogens". Microbiol Mol Biol Rev. 65 (4). ss. 595-626. doi:10.1128/MMBR.65.4.595-626.2001. PMID 11729265.
- ^ Boucher Y, Douady CJ, Papke RT, Walsh DA, Boudreau ME, Nesbo CL, Case RJ, Doolittle WF (2003). "Lateral gene transfer and the origins of prokaryotic groups". Annu Rev Genet. Cilt 37. ss. 283-328. doi:10.1146/annurev.genet.37.050503.084247. PMID 14616063.
- ^ Olsen G, Woese C, Overbeek R (1994). "The winds of (evolutionary) change: breathing new life into microbiology". J Bacteriol. 176 (1). ss. 1-6. PMID 8282683.[ölü/kırık bağlantı]
- ^ "IJSEM - Home". 17 Mayıs 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ "Bergey's Manual Trust". 28 Mart 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Gupta R (2000). "The natural evolutionary relationships among prokaryotes". Crit Rev Microbiol. 26 (2). ss. 111-31. doi:10.1080/10408410091154219. PMID 10890353.
- ^ Doolittle RF (2005). "Evolutionary aspects of whole-genome biology". Curr Opin Struct Biol. 15 (3). ss. 248-253. doi:10.1016/j.sbi.2005.04.001. PMID 11837318.
- ^ Cavalier-Smith T (2002). "The neomuran origin of archaebacteria, the negibacterial root of the universal tree and bacterial megaclassification". Int J Syst Evol Microbiol. 52 (Pt 1). ss. 7-76. PMID 11837318.
- ^ Ciccarelli FD, Doerks T, von Mering C, Creevey CJ, Snel B, Bork P (2006). "Toward automatic reconstruction of a highly resolved tree of life". Science. 311 (5765). ss. 1283-7. doi:10.1126/science.1123061. PMID 16513982.
- ^ Woods G, Walker D (1996). "Detection of infection or infectious agents by use of cytologic and histologic stains". Clin Microbiol Rev. 9 (3). ss. 382-404. PMID 8809467.[ölü/kırık bağlantı]
- ^ Weinstein M (1994). "Clinical importance of blood cultures". Clin Lab Med. 14 (1). ss. 9-16. PMID 8181237.
- ^ Louie M, Louie L, Simor AE (2000). "The role of DNA amplification technology in the diagnosis of infectious diseases". CMAJ. 163 (3). ss. 301-309. PMID 10951731. 14 Haziran 2006 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Oliver J. "The viable but nonculturable state in bacteria". J Microbiol. Cilt 43 Spec No. ss. 93-100. PMID 15765062. 4 Nisan 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ "Arşivlenmiş kopya". 11 Eylül 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Curtis T, Sloan W, Scannell J (2002). "Estimating prokaryotic diversity and its limits". Proc Natl Acad Sci U S a. 99 (16). ss. 10494-9. doi:10.1073/pnas.142680199. PMID 12097644.[ölü/kırık bağlantı]
- ^ Schloss P, Handelsman J (2004). "Status of the microbial census". Microbiol Mol Biol Rev. 68 (4). ss. 686-91. doi:10.1128/MMBR.68.4.686-691.2004. PMID 15590780. 8 Nisan 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Stams A, de Bok F, Plugge C, van Eekert M, Dolfing J, Schraa G (2006). "Exocellular electron transfer in anaerobic microbial communities". Environ Microbiol. 8 (3). ss. 371-82. doi:10.1111/j.1462-2920.2006.00989.x. PMID 16478444.
- ^ Barea J, Pozo M, Azcón R, Azcón-Aguilar C (2005). "Microbial co-operation in the rhizosphere". J Exp Bot. 56 (417). ss. 1761-78. doi:10.1093/jxb/eri197. PMID 15911555. 16 Şubat 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ O'Hara A, Shanahan F (2006). "The gut flora as a forgotten organ". EMBO Rep. 7 (7). ss. 688-93. doi:10.1038/sj.embor.7400731. PMID 16819463.
- ^ Zoetendal E, Vaughan E, de Vos W (2006). "A microbial world within us". Mol Microbiol. 59 (6). ss. 1639-50. doi:10.1111/j.1365-2958.2006.05056.x. PMID 16553872.
- ^ Gorbach S (1990). "Lactic acid bacteria and human health". Ann Med. 22 (1). ss. 37-41. doi:10.3109/07853899009147239. PMID 2109988.
- ^ Salminen S, Gueimonde M, Isolauri E (2005). "Probiotics that modify disease risk". J Nutr. 135 (5). ss. 1294-8. PMID 15867327. 23 Mart 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- ^ Fish D. "Optimal antimicrobial therapy for sepsis". Am J Health Syst Pharm. Cilt 59 Suppl 1. ss. S13-9. PMID 11885408.
- ^ Belland R, Ouellette S, Gieffers J, Byrne G (2004). "Chlamydia pneumoniae and atherosclerosis". Cell Microbiol. 6 (2). ss. 117-27. doi:10.1046/j.1462-5822.2003.00352.x. PMID 14706098.
- ^ Heise E (1982). "Diseases associated with immunosuppression". Environ Health Perspect. Cilt 43. ss. 9-19. doi:10.2307/3429162. PMID 7037390.[ölü/kırık bağlantı]
- ^ Saiman, L. "Microbiology of early CF lung disease". Paediatr Respir Rev.volume=5 Suppl a. ss. S367-369. PMID 14980298
- ^ Yonath A, Bashan A (2004). "Ribosomal crystallography: initiation, peptide bond formation, and amino acid polymerization are hampered by antibiotics". Annu Rev Microbiol. Cilt 58. ss. 233-51. doi:10.1146/annurev.micro.58.030603.123822. PMID 15487937.
- ^ Khachatourians G (1998). "Agricultural use of antibiotics and the evolution and transfer of antibiotic-resistant bacteria". CMAJ. 159 (9). ss. 1129-36. PMID 9835883.[ölü/kırık bağlantı]
- ^ Johnson M, Lucey J (2006). "Major technological advances and trends in cheese". J Dairy Sci. 89 (4). ss. 1174-8. PMID 16537950.
- ^ Hagedorn S, Kaphammer B (1994). "Microbial biocatalysis in the generation of flavor and fragrance chemicals". Annu. Rev. Microbiol. Cilt 48. ss. 773-800. doi:10.1146/annurev.mi.48.100194.004013. PMID 7826026.
- ^ Cohen Y (2002). "Bioremediation of oil by marine microbial mats". Int Microbiol. 5 (4). ss. 189-93. doi:10.1007/s10123-002-0089-5. PMID 12497184.
- ^ Neves LC, Miyamura TT, Moraes DA, Penna TC, Converti A (2006). "Biofiltration methods for the removal of phenolic residues". Appl. Biochem. Biotechnol. Cilt 129-132. ss. 130-52. PMID 16915636.
- ^ Liese A, Filho M (1999). "Production of fine chemicals using biocatalysis". Curr Opin Biotechnol. 10 (6). ss. 595-603. doi:10.1016/S0958-1669(99)00040-3. PMID 10600695.
- ^ Aronson AI, Shai Y (2001). "Why Bacillus thuringiensis insecticidal toxins are so effective: unique features of their mode of action". FEMS Microbiol. Lett. 195 (1). ss. 1-8. PMID 11166987.
- ^ Bozsik A (2006). "Susceptibility of adult Coccinella septempunctata (Coleoptera: Coccinellidae) to insecticides with different modes of action". Pest Manag Sci. 62 (7). ss. 651-4. doi:10.1002/ps.1221. PMID 16649191.
- ^ Chattopadhyay A, Bhatnagar N, Bhatnagar R (2004). "Bacterial insecticidal toxins". Crit Rev Microbiol. 30 (1). ss. 33-54. doi:10.1080/10408410490270712. PMID 15116762.
- ^ Serres M, Gopal S, Nahum L, Liang P, Gaasterland T, Riley M (2001). "A functional update of the Escherichia coli K-12 genome". Genome Biol. 2 (9). ss. RESEARCH0035. doi:10.1186/gb-2001-2-9-research0035. PMID 11574054.[ölü/kırık bağlantı]
- ^ Almaas E, Kovács B, Vicsek T, Oltvai Z, Barabási A (2004). "Global organization of metabolic fluxes in the bacterium Escherichia coli". Nature. 427 (6977). ss. 839-43. doi:10.1038/nature02289. PMID 14985762.
- ^ Reed JL, Vo TD, Schilling CH, Palsson BO (2003). "An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR)". Genome Biol. 4 (9). ss. R54. doi:10.1186/gb-2003-4-9-r54. PMID 12952533.
- ^ Walsh G (2005). "Therapeutic insulins and their large-scale manufacture". Appl Microbiol Biotechnol. 67 (2). ss. 151-9. doi:10.1007/s00253-004-1809-x. PMID 15580495.
- ^ Graumann K, Premstaller A (2006). "Manufacturing of recombinant therapeutic proteins in microbial systems". Biotechnol J. 1 (2). ss. 164-86. doi:10.1002/biot.200500051. PMID 16892246.
Daha fazla okumak için
[değiştir | kaynağı değiştir]- Alcamo IE (2001). Fundamentals of microbiology. Boston: Jones and Bartlett. ISBN 0-7637-1067-9.
- Atlas RM (1995). Principles of microbiology. St. Louis: Mosby. ISBN 0-8016-7790-4.
- Martinko JM, Madigan MT (2005). Brock Biology of Microorganisms (11. ed. bas.). Englewood Cliffs, N.J: Prentice Hall. ISBN 0-13-144329-1.
- Holt JC, Bergey DH (1994). Bergey's manual of determinative bacteriology (9. ed. bas.). Baltimore: Williams & Wilkins. ISBN 0-683-00603-7.
- Hugenholtz P, Goebel BM, Pace NR (1998). "Impact of culture-independent studies on the emerging phylogenetic view of bacterial diversity". J Bacteriol. 180 (18). ss. 4765-74. PMID 9733676. 14 Eylül 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ağustos 2008.
- Funke BR, Tortora GJ, Case CL (2004). Microbiology: an introduction (8. ed bas.). San Francisco: Benjamin Cummings. ISBN 0-8053-7614-3.
Dış bağlantılar
[değiştir | kaynağı değiştir]| Vikisözlük'te tanımlar | |
| Commons'ta dosyalar | |
| Vikitür'de taksonomi | |
- Bacterial DSMZ'den güncel bilimsel bakteri adlandırması29 Eylül 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- En büyük bakteri11 Aralık 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- Hayat ağacı: Eubacteria21 Ekim 2014 tarihinde Wayback Machine sitesinde arşivlendi.
- Yüzen bakteri videoları5 Kasım 2015 tarihinde Wayback Machine sitesinde arşivlendi..
- Bakterilerin gezegeni22 Haziran 2019 tarihinde Wayback Machine sitesinde arşivlendi. (Stephen Jay Gould)
- Çevrimiçi bakteriyoloji ders kitabı13 Eylül 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- Bakteri hücre yapısına animasyonlu rehber.9 Nisan 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- Laboratuvarda bakteriler evrimsel bir sıçrama yapıyor9 Ekim 2008 tarihinde Wayback Machine sitesinde arşivlendi.
- bakteri metabolizması


