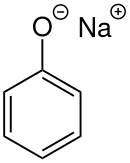
Sodyum fenolat
| |
Diğer adlar Sodyum fenoksit | |
| Tanımlayıcılar | |
|---|---|
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.004.862 |
PubChem CID
|
|
| UNII | |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | C6H5NaO |
| Molekül kütlesi | 116.09 g/mol |
| Görünüm | beyaz katı |
| Erime noktası | 384°C |
| Çözünürlük (su içinde) | Suda çok çözünür. |
| Çözünürlük | Alkol ve asetonda çözünür |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Zararlı, Aşındırıcı |
| GHS etiketleme sistemi: | |
| Piktogramlar | 
|
| İşaret sözcüğü | Aşındırıcı |
| Tehlike ifadeleri | H314 |
| Önlem ifadeleri | P260, P264, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P363, P405, P501 |
| Parlama noktası | Tutuşmaz |
| Tutuşmaz | |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Sodyum fenolat (sodyum fenoksit) NaOC6H5 formülüne sahip bir organik bileşiktir. Beyaz kristalimsi bir katıdır. Aynı zamanda fenoksit olarak da bilinen fenolat anyonu, fenolün konjuge bazıdır. Aril eterler gibi diğer birçok organik bileşiğin öncül maddesi olarak kullanılır.
Sentezi ve yapısı
[değiştir | kaynağı değiştir]En yaygın olarak, sodyum fenolat çözeltileri, fenolün sodyum hidroksit ile reaksiyonu ile üretilir.[1] Susuz türevleri, fenol ve sodyum birleştirilerek hazırlanabilir:
- Na + HOC6H5 → NaOC6H5 + 1/2 H2
Diğer sodyum alkoksitler gibi, kristal sodyum fenolat da çoklu Na-O bağlarını içeren karmaşık bir yapı benimser. Çözücü içermeyen malzeme polimeriktir, her Na merkezi üç oksijen ligandına ve fenil halkasına bağlıdır. Sodyum fenolat katma bileşikleri küban tipi grup bileşiği [NaOPh]4(HMPA)4 gibi moleküllerdir.[2]
Sodyum fenolat benzensülfonik asitin "alkali ergitme"si ile üretilebilir, burada sülfonat grupları hidroksit ile yer değiştirir:
- C6H5SO3Na + 2 NaOH → C6H5ONa + Na2SO3
Bu yol bir zamanlar fenolün ana endüstriyel üretim yoluydu.

Reaksiyonları
[değiştir | kaynağı değiştir]Sodyum fenolat orta derecede kuvvetli bir bazdır. Asitleştirme fenol verir:[3]
- PhOH ⇌ PhO− + H+ (K = 10−10)
Alkilleme fenil eterleri oluşturur:[1]
- NaOC6H5 + RBr → ROC6H5 + NaBr
Dönüşüm, Williamson eter sentezinin bir uzantısıdır. Alkilleyici maddelerle esterlerinden biri elde edilir:
- NaOC6H5 + RC(O)Cl → RCO2C6H5 + NaCl
Sodyum fenolat, bazı elektrofilik aromatik sübstitüsyon tiplerine duyarlıdır. Örneğin, salisilik asitin konjuge bazı olan 2-hidroksibenzoat oluşturmak için karbon dioksit ile reaksiyona girer. Bununla birlikte, genel olarak, elektrofiller geri dönüşü olmayan bir şekilde fenolat içindeki oksijen merkezine saldırır.

Kullanımı
[değiştir | kaynağı değiştir]Sodyum fenolat mikroorganizmaların büyümesini yok eder veya engeller. Bu nedenle insanlar kokuyu önlemek ve cildi temizlemek için kullanırlar. Sodyum fenolat, bakterilerin büyümesini önler veya yavaşlatır. Böylece kozmetik ve kişisel bakım ürünlerini koruyabilir.[4]
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b C. S. Marvel, A. L. Tanenbaum (1929). "γ-Phenoxypropyl Bromide". Org. Synth. 9: 72. doi:10.15227/orgsyn.009.0072.
- ^ Michael Kunert, Eckhard Dinjus, Maria Nauck, Joachim Sieler "Structure and Reactivity of Sodium Phenoxide - Following the Course of the Kolbe-Schmitt Reaction" Chemische Berichte 1997 Volume 130, Issue 10, pages 1461–1465. DOI:10.1002/cber.19971301017
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th bas.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ "Sodium Phenoxide | Cosmetics Info". cosmeticsinfo.org. 7 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Haziran 2020.
