Sezyum klorür
Bu madde hiçbir kaynak içermemektedir. (Mayıs 2022) (Bu şablonun nasıl ve ne zaman kaldırılması gerektiğini öğrenin) |

| |
| |
| Adlandırmalar | |
|---|---|
Sezyum klorür | |
Diğer adlar Sezyum Klorür | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.028.728 |
PubChem CID
|
|
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
| Molekül formülü | CsCI |
| Molekül kütlesi | 168.36 g/mol |
| Görünüm | beyaz katı |
| Erime noktası | 646 °C (1,195 °F; 919 K |
| Kaynama noktası | 1,297 °C (2,367 °F; 1,570 K) |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler |  
|
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
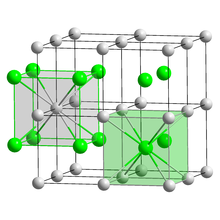
Sezyum klorür, CsCl formülüne sahip inorganik bileşiktir. Bu renksiz tuz, çeşitli uygulamalarda önemli bir sezyum iyonu kaynağıdır. Kristal yapısı, her bir sezyum iyonunun 8 klor iyonu ile koordine edildiği önemli bir yapısal tip oluşturur. Sezyum klorür suda çözünür.
Sezyum klorür, çeşitli DNA türlerini ayırmak için izopiknik santrifüjlemede yaygın olarak kullanılan ilaç yapısıdır . İyonları çökeltinin rengi ve morfolojisine göre tanımlamak için kullanıldığı analitik kimyada bir reaktiftir. 137 CsCl veya 131 CsCl gibi radyoizotoplar açısından zenginleştirildiğinde sezyum klorür, kanser tedavisi ve miyokard enfarktüsü teşhisi gibi nükleer tıp uygulamalarında kullanılır. Başka bir kanser tedavisi biçimi, geleneksel radyoaktif olmayan CsCl kullanılarak incelenmiştir. Geleneksel sezyum klorür, insanlar ve hayvanlar için oldukça düşük bir toksisiteye sahipken, radyoaktif form, CsCl'nin sudaki yüksek çözünürlüğü nedeniyle çevreyi kolayca kirletmektedir. 1987'de Brezilya'nın Goiânia kentinde 93 gramlık bir kaptan 137 CsCl tozunun yayılması, dört kişinin ölümüne ve 100.000'den fazla insanı doğrudan etkileyen, şimdiye kadarki en kötü radyasyon dökülme kazalarından birine neden oldu.[kaynak belirtilmeli]
Reaksiyonlar
[değiştir | kaynağı değiştir]Sezyum klorür suda çözündükten sonra tamamen ayrışır ve Cs+ katyon'ler seyreltik solüsyonda çözüldü olur. CsCl, konsantre sülfürik asit içinde ısıtıldığında veya 550–700 °C'de sezyum hidrojen sülfat ile ısıtıldığında sezyum sülfat'a dönüşür:
- 2 CsCl + H2SO4 → Cs2SO4 + 2 HCl
- CsCl + CsHSO4 → Cs2SO4 + HCl
Sezyum klorür, diğer klorürlerle çeşitli çift tuzlar oluşturur. Örnekler arasında 2CsCl·BaCl2, 2CsCl·CuCl2, CsCl·2CuCl ve CsCl·LiCl ve ile interhalojen bileşikleri:
Kaynaklar
[değiştir | kaynağı değiştir]| Kimya ile ilgili bu madde taslak seviyesindedir. Madde içeriğini genişleterek Vikipedi'ye katkı sağlayabilirsiniz. |

![{\displaystyle {\ce {CsCl + ICl3 -> Cs[ICl4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b106856bd4fcba7764e52dc61de8ec0049b4a3e)