Kloropikrin
Görünüm
| |||
| Adlandırmalar | |||
|---|---|---|---|
trikloro(nitro)metan | |||
Diğer adlar Tri-clor 99.6, PS, Nitrokloroform, Trikloronitrometan | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| 1756135 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.847 | ||
| EC Numarası |
| ||
| 240197 | |||
| KEGG | |||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| UN numarası | 1580 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
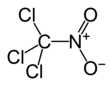
| Molekül formülü | CCl3NO2 | ||
| Molekül kütlesi | 164.375 g/mol | ||
| Görünüm | renksiz sıvı | ||
| Koku | keskin, rahatsız edici[1] | ||
| Yoğunluk | 1.692 g/ml[2] | ||
| Erime noktası | -69 °C (-92 °F; 204 K) | ||
| Kaynama noktası | 112 °C (234 °F; 385 K) (bozunur) | ||
| Çözünürlük (su içinde) | %0,2[1] | ||
| Buhar basıncı | 18 mmHg (20°C)[1] | ||
| -75.3·10−6 cm3/mol | |||
| Tehlikeler | |||
| İş sağlığı ve güvenliği (OHS/OSH): | |||
| Ana tehlikeler | Aşırı zehirli ve dokuları tahriş eder | ||
| GHS etiketleme sistemi: | |||
| Piktogramlar |    
| ||
| İşaret sözcüğü | Danger | ||
| Tehlike ifadeleri | H301, H314, H330, H370, H372, H410 | ||
| Önlem ifadeleri | P260, P264, P270, P271, P273, P280, P284, P301+P310, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P307+P311, P310, P314, P320, P321, P330, P363, P391, P403+P233, P405, P501 | ||
| NFPA 704 (yangın karosu) |
|||
| Öldürücü doz veya konsantrasyon (LD, LC): | |||
LC50 (medyan konsantrasyon)
|
9.7 ppm (mouse, 4 hr) 117 ppm (rat, 20 min) 14.4 ppm (rat, 4 hr)[3] | ||
LCLo (yayınlanan en düşük)
|
293 ppm (insan, 10 dakika) 340 ppm (fare, 1 dakika) 117 ppm (kedi, 20 dakika)[3] | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | TWA 0.1 ppm (0.7 mg/m3)[1] | ||
| REL (tavsiye edilen) | TWA 0.1 ppm (0.7 mg/m3)[1] | ||
| IDLH (anında tehlike) | 2 ppm[1] | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
Kloropikrin, (PS ve nitrokloroform olarak da bilinir) şu anda geniş spektrumlu bir antimikrobiyal, fungisit, herbisit, insektisit ve nematisit olarak kullanılan bir kimyasal bileşiktir.[4] Birinci Dünya Savaşı'nda zehirli gaz olarak kullanılmıştır. Kimyasal yapı formülü Cl
3CNO
2'dir.
Üretimi
[değiştir | kaynağı değiştir]
Kloropikrin, 1848'de İskoç kimyager John Stenhouse tarafından keşfedildi. Sodyum hipokloritin pikrik asit ile reaksiyona girmesiyle hazırladı:
- HOC6H2(NO2)3 + 11 NaOCl → 3 Cl3CNO2 + 3 Na2CO3 + 3 NaOH + 2 NaCl
Kullanılan öncül nedeniyle Stenhouse, iki bileşiğin yapısal olarak farklı olmasına rağmen bileşiğe "kloropikrin" adını verdi.
Günümüzde kloropikrin, nitrometan ile sodyum hipokloritin reaksiyonu sonucu üretilmektedir:[5]
- H3CNO2 + 3 NaOCl → Cl3CNO2 + 3 NaOH
Kloroform ve nitrik asit de kloropikrin verebilir:
- CHCl3 + HNO3 → CCl3NO2 + H2O
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b c d e f NIOSH Pocket Guide to Chemical Hazards. "#0132". National Institute for Occupational Safety and Health (NIOSH).
- ^ http://msds.chem.ox.ac.uk/CH/chloropicrin.html [ölü/kırık bağlantı]
- ^ a b "Chloropicrin". Immediately Dangerous to Life or Health Concentrations (IDLH). Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH).
- ^ "RED Fact Sheet: Chloropicrin" (PDF). US Environmental Protection Agency. 10 Temmuz 2008. s. 2. 6 Ekim 2013 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 20 Eylül 2013.
- ^ Sheldon B. Markofsky "Nitro Compounds, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.