İyot heptaflorür
| |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Diğer adlar İyot(VII) florür Heptafloroiyot | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.037.241 | ||
PubChem CID
|
|||
| UNII | |||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| |||
| Özellikler | |||
| Molekül formülü | IF7 | ||
| Molekül kütlesi | 259.90 g/mol | ||
| Görünüm | renksiz gaz | ||
| Yoğunluk | 2.6 g/cm3 (6 °C) 2.7 g/cm3 (25 °C) | ||
| Erime noktası | 45 °C (113 °F; 318 K) (üçlü nokta) | ||
| Kaynama noktası | 48 °C (118 °F; 321 K) | ||
| Çözünürlük (su içinde) | soluble [1] | ||
| Benzeyen bileşikler | |||
Benzeyen bileşikler
|
iyot pentaflorür | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
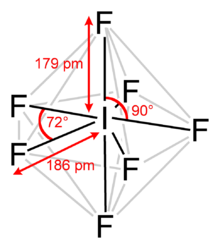
İyot heptaflorür, diğer adıyla iyot(VII) florür ya da iyot florür, IF7 kimyasal formülüne sahip interhalojen bileşiktir.[2][3] VSEPR teorisinde öngörüldüğü gibi alışılmadık bir beşgen bipiramidal yapıya sahiptir.[4] Molekül, Berry mekanizmasına benzeyen ancak heptakoordineli bir sistem için kullanılan sahte bir Bartell mekanizması isimli bir yeniden düzenlemeye tabi tutulabilir.[5] 4.5 °C'de eriyen renksiz kristallerden oluşur: sıvı aralığı son derece dardır, kaynama noktası 4.77 °C'dedir. Yoğun buhar, küflü ve buruk bir kokuya sahiptir. Molekül D5h simetriye sahiptir.
Hazırlanması
[değiştir | kaynağı değiştir]IF7 sıvı IF5'ten 90 °C'de F2 geçirilerek hazırlanır, sonra buhar 270 °C'ye ısıtılır. Alternatif olarak, bu bileşik, hidrolizden kaynaklanan bir safsızlık olan IOF5 oluşumunu en aza indirmek için flor ve kurutulmuş paladyum veya potasyum iyodürden hazırlanabilir.[6][7] İyot heptaflorür aynı zamanda, dioksijenil hekzafloroplatinat, iyot pentaflorür çözeltisi içinde potasyum florür kullanılarak potasyum heksafloroplatinat (V) gibi diğer platin(V) bileşiklerinin hazırlanması için kullanıldığında yan ürün olarak elde edilir.[8]
- 2 O2PtF6 + 2 KF + IF5 → 2 KPtF6 + 2 O2 + IF7
Güvenlik hususları
[değiştir | kaynağı değiştir]IF7 hem cildi, hem de mukoza zarını tahriş edicidir. Aynı zamanda güçlü bir oksitleyicidir ve organik malzeme ile temasında yangına neden olabilir.
Kaynakça
[değiştir | kaynağı değiştir]- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, 0-07-049439-8
- ^ Macintyre, JE (Ed.). (1992). İnorganik Bileşikler Sözlüğü (Cilt 3). Londra: Chapman ve Salon.
- ^ O'Neil, Maryadele J. (Ed.). (2001). Merck İndeksi (13. basım). Whitehouse İstasyonu, NJ: Merck.
- ^ Boş kaynak (yardım)
- ^ W. J. Adams; H. Bradford Thompson; L. S. Bartell (1970). "Structure, Pseudorotation, and Vibrational Mode Coupling in IF7: An Electron Diffraction Study". Journal of Chemical Physics. 53 (10): 4040–4046. doi:10.1063/1.1673876
- ^ Schumb, W. C.; Lynch, M. A. (1950). "Iodine Heptafluoride". Industrial & Engineering Chemistry. 42 (7): 1383–1386. doi:10.1021/ie50487a035
- ^ Ruff, O.; Keim, R. (1930). ""Das Jod-7-fluorid" (The iodine-7-fluoride)". Zeitschrift für Anorganische und Allgemeine Chemie (in German). 193 (1/2): 176–186. doi:10.1002/zaac.19301930117
- ^ Beveridge, A. D.; Clark, H. C. (1967). "Pentahalides of the Transition Metals". In Gutmann, Viktor. Halogen Chemistry 18 Şubat 2019 tarihinde Wayback Machine sitesinde arşivlendi.. 3. Academic Press. pp. 179–226. ISBN 9780323148474
Dış bağlantılar
[değiştir | kaynağı değiştir]- IF7 için WebBook sayfası18 Şubat 2019 tarihinde Wayback Machine sitesinde arşivlendi.
- Ulusal Kirletici Envanteri - Florür ve bileşenleri
- web elemanları listeleme12 Mayıs 2008 tarihinde Wayback Machine sitesinde arşivlendi.