Ödül sistemi
Ödül sistemi (mezokortikolimbik devre); teşvik edicilik özelliği (yani "istemek"; bir ödül ve motivasyonu arzulamak), çağrışımsal öğrenme (öncelikle olumlu pekiştirme ve klasik koşullanma) ve pozitif değere sahip duygulardan (özellikle ana bileşen olarak hazzı içeren duygular; örneğin keyif, öfori ve coşku) sorumlu bir grup nöral yapıdır.[1][2] Ödül, bir uyaranın iştah (yaklaşma) ve tüketme davranışlarına yol açan çekici ve güdüsel özellikleridir.[1] Ödüllendirici bir uyaran şu şekilde tanımlanmaktadır: "Bizi ona yaklaşmaya ve onu tüketmeye yöneltme potansiyeli olan her uyaran, nesne, olay, aktivite veya durum; tanımı gereği bir ödüldür".[1] Edimsel koşullamada ödüllendirici uyaranlar, olumlu pekiştireç olarak işlev görürler[1] fakat bu ifadenin tersi de doğrudur; olumlu pekiştireçler ödüllendiricidir.[1]
Ödül sistemi, hayvanları uyaranlara yaklaşmaya veya zindeliği artıran davranışlarda bulunmaya (seks, enerji içeriği yüksek gıda tüketimi vb.) güdüler. Çoğu hayvan türü için hayatta kalma, yararlı uyaranlarla teması en üst düzeye çıkarmaya ve zararlı uyaranlarla teması en aza indirmeye bağlıdır. Ödül bilişi, çağrışımsal öğrenmeye sebep olarak, yaklaşma ve tüketme davranışlarını ortaya çıkararak ve pozitif değerlikli duyguları tetikleyerek hayatta kalma ve üreme ihtimallerini arttırmaya hizmet eder.[1] Bu nedenle ödül, hayvanların adaptasyona bağlı uyum gücünü (adaptive fitness) artırmaya yardımcı olmak için gelişen bir mekanizmadır.[3] Uyuşturucu bağımlılığında, bazı maddeler ödül devresini aşırı aktive ederek devredeki sinaptik plastisiteden kaynaklanan, takıntılı bir madde-arama davranışına (compulsive substance-seeking behavior) yol açar.[4]
Birincil ödüller, kişinin kendisinin ve yavrularının hayatta kalmasını kolaylaştıran bir ödüllendirici uyaran sınıfıdır ve bunlar, homeostatik ödülleri (örneğin lezzetli yiyecekler) ve üreme ödüllerini (örneğin, cinsel temas ve ebeveynlerin yavruları için yaptığı yatırımlar) içerir.[1][5] İçsel ödüller, çekici olan ve doğası gereği zevkli oldukları için davranışı motive eden koşulsuz ödüllerdir.[1] Dışsal ödüller (örneğin, para ya da en sevdiğin spor takımının bir oyunu kazandığını görmek) çekici ve davranışı motive eden ancak doğal olarak zevkli olmayan koşullu ödüllerdir.[1][6] Dışsal ödüller, içsel ödüllerle olan ilişkilerinin öğrenilmesi (yani koşullanma) sayesinde motivasyonel değerlerini elde eder.[1] Dışsal ödüller, içsel ödüllerle yapılan klasik koşullanmadan sonra, zevk (örneğin, bir piyangoda çok para kazanmanın verdiği coşku) de ortaya çıkarabilir.[1]
Tanım
[değiştir | kaynağı değiştir]Nörobilimde ödül sistemi, ödülle ilişkili bilişten sorumlu beyin yapıları ve nöral yolaklardır. Ödül bilişi; çağrışımsal öğrenme (öncelikle klasik koşullanma ve olumlu pekiştirme), teşvik edicilik (yani "istemek"; bir ödül ve motivasyonu arzulamak) ve pozitif değerlikli duyguları (özellikle hazzı içeren duygular; örneğin hedonik "beğenme") içerir.[1]
Ödülün "isteme" veya arzu bileşeniyle ilgili davranışı tanımlamak için yaygın olarak kullanılan terimler arasında iştah belirten davranış, yaklaşma davranışı, hazırlık davranışı, araçsal davranış (instrumental behavior), beklenti davranışı ve arama (seeking) yer alır.[7] Ödülün "beğenme" veya haz bileşeniyle ilgili davranışı tanımlamak için yaygın olarak kullanılan terimlerden bazıları ise tüketme davranışı ve alma davranışıdır.[7]
Ödüllerin üç temel işlevi, aşağıdakileri gerçekleştirme kapasiteleridir:
- çağrışımsal öğrenme üretmek (yani, klasik koşullanma ve edimsel pekiştirme);[1]
- karar vermeyi etkilemek ve yaklaşma davranışını teşvik etmek (ödüllendirici uyaranlara motivasyonel ilginin atanması yoluyla);[1]
- pozitif değerlikli duyguları, özellikle de hazzı ortaya çıkarmak.[1]
Nöroanatomi
[değiştir | kaynağı değiştir]Genel bakış
[değiştir | kaynağı değiştir]Ödül sistemini oluşturan beyin yapıları öncelikle kortiko-bazal gangliyon-talamo-kortikal döngü içinde yer alır;[8] döngünün bazal gangliyon kısmı, ödül sistemi içindeki aktiviteyi yönlendirir.[8] Ödül sistemi içindeki yapıları birbirine bağlayan yolakların çoğu; glutamaterjik internöronlar, GABAerjik orta boy dikensi nöronlar (medium spiny neurons) ve dopaminerjik projeksiyon nöronlarını içerir,[8][9] ancak diğer projeksiyon nöronları da sisteme katkıda bulunur (örneğin, oreksinerjik projeksiyon nöronları). Ödül sistemi; ventral tegmental alan, ventral striatum (yani, nükleus akumbens ve koku alma tüberkülü), dorsal striatum (yani, kaudat nükleus ve putamen), substantia nigra (yani, pars kompakta ve pars reticulata), prefrontal korteks, anterior singulat korteks, insular korteks, hipokampus, hipotalamus (özellikle lateral hipotalamustaki oreksinerjik nükleus), talamus (çok sayıda çekirdeği), subtalamik nükleus, pallidum (hem dış hem de iç pallidum), ventral pallidum, parabrakial nükleus, amigdala ve genişletilmiş amigdalanın geri kalanını içerir.[2][8][10][11][12] Dorsal raphe çekirdeği ve serebellum, ödülle ilgili bazı biliş biçimlerini (yani, ilişkisel öğrenme, motivasyonel dikkat ve olumlu duygular) ve davranışları modüle ediyor gibi görünmektedir.[13][14][15] Laterodorsal tegmental çekirdek (LTD), pedunculopontine çekirdek (PPTg) ve lateral habenula (LHB) (hem doğrudan hem derostromediyal tegmental çekirdek (RMTg) aracılığıyla dolaylı olarak) da; VTA'ya yaptıkları projeksiyonlar sayesinde hem teşvik edicilik (incentive salience) hem de caydırıcılık (tiksinme yüzünden) oluşturma kapasitesine sahiptir.[16] LDT ve PPTg'nin her ikisi de, dopaminerjik nöronlarla sinaps kurmak üzere glutamaterjik projeksiyonlar gönderir ve bu iki bölge de teşvik edicilik üretebilir. LHb, çoğu RMTg'deki GABAerjik nöronlarla sinaps kuran glutamaterjik projeksiyonlar gönderir ve RMTg'deki bu nöronlar da dopaminerjik VTA nöronlarının engellenmesi işlevini yürütür; fakat bazı LHb projeksiyonları da VTA internöronlarında sonlanır. Bu LHb projeksiyonları, hem caydırıcı uyaranlar hem de beklenen bir ödülün yokluğu ile aktive edilir ve LHb'nin uyarılması, isteksizliği (tiksinmeyi) indükleyebilir.[17][18][19]
Ventral tegmental alandan projeksiyon yapan dopamin yolaklarının çoğu (diğer nöronlarla iletişim kurmak için dopamin nörotransmitterini kullanan nöronlar) ödül sisteminin bir parçasıdır;[8] bu yolaklarda dopamin, cAMP üretimini uyarmak veya inhibe etmek için sırasıyla D1-benzeri reseptörler veya D2-benzeri reseptörler üzerinde etki gösterir.[20] Striatumdaki GABAerjik orta boy dikensi nöronlar da ödül sisteminin birer bileşenidir.[8] Subtalamik nükleustaki glutamaterjik projeksiyon çekirdekleri, prefrontal korteks, hipokampus, talamus ve amigdala, glutamaterjik yolaklar aracılığıyla ödül sisteminin diğer bölümlerine bağlanır.[8] Beyin stimülasyon ödülüne (yani lateral hipotalamusun doğrudan elektrokimyasal stimülasyonuyla elde edilen ödül) aracılık eden birçok nöral yolaktan oluşan medial ön beyin demeti de ödül sisteminin bir bileşenidir.[21]
Nükleus akumbensin (NAc) aktivitesi ile beğenme ve isteme davranışlarının ortaya çıkışı arasındaki ilişki hakkında iki teori vardır. İnhibisyon (veya hiperpolarizasyon) hipotezi; NAc'nin ventral pallidum, hipotalamus veya ventral tegmental alan gibi devrenin devamındaki yapılar üzerinde tonik inhibitör etki uyguladığını, NAc'deki orta boy dikensi nöronların inhibe edilmesi ile de bu yapıların aktive edildiğini, dolayısıyla ödülle ilgili davranışların ortaya çıktığını öne sürer. GABA reseptör agonistleri, nükleus akumbenste hem "beğenme" hem de "isteme" reaksiyonlarını ortaya çıkarma yeteneğine sahipkenbazolateral amigdala, ventral hipokampus ve medial prefrontal korteksten gelen glutamaterjik girdiler, teşvik edici belirginliği sağlayabilir. Ayrıca, çoğu çalışma, NAc nöronlarının ödüle yanıt olarak ateşlenmeyi azalttığını bulsa da, bir dizi çalışma tam tersi yanıtı bulmuştur. Bu da ödülle ilgili davranışların, NAc nöronlarının uyarılması sonucu ortaya çıktığını öne süren disinhibisyon hipotezinin sunulmasına yol açmıştır.[22][23]
Beyin stimülasyonu ödülü üzerine yaklaşık 50 yıllık bir araştırmadan sonra, uzmanlar beyindeki düzinelerce bölgenin; buralara uyarıcı elektrotlar yerleştirildiği ve hayvanların buraları -örneğin bir düğmeye basarak- uyarabilmesine olanak tanındığı takdirde bu davranışın (intrakraniyal kendi kendini uyarma davranışı) devamlı sürdürüleceğini onayladılar. Bu bölgelerden, lateral hipotalamus ve medial ön beyin demetleri, intrakraniyal kendi kendini uyarma davranışını ortaya çıkarmakta özellikle etkilidir. Oradaki uyarım, yükselen yolakları (ascending pathways) oluşturan fiberleri harekete geçirir; yükselen yolaklar, ventral tegmental alandan nükleus akumbense uzanan mezolimbik dopamin yolağını içerir. Mezolimbik dopamin yolağının ödüle aracılık eden devrelerde neden merkezi olduğuna dair birkaç açıklama var. İlk olarak, hayvanlarda intrakraniyal kendi kendini uyarma deneyleri esnasında mezolimbik yolaktan dopamin salınımında belirgin bir artış vardır.[3] İkincisi, deneyler tutarlı bir şekilde beyin stimülasyon ödülünün, normalde doğal ödüller veya ödül olarak kullanılabilen ilaçlarla aktive olan yolakların güçlendirilmesini kolaylaştırdığını gösteriyor; ya da intrakraniyal kendi kendini uyarma, ödül merkezini çevresel sinirler aracılığıyla değil de direkt olarak uyardığı için merkezi ödül mekanizmalarının daha güçlü aktive olmasını sağlayabiliyor[3][24][25] Üçüncüsü, hayvanlara bağımlılık yapan ilaçlar verildiğinde veya hayvanlar beslenme ve cinsel aktivite gibi doğal olarak ödüllendirici davranışlarda bulunduğunda, nükleus akumbens içinde belirgin bir dopamin salımı olur.[3] Bununla birlikte dopamin, beyinde ödüle dair tek bileşen değildir.
Ana (En Kritik) Yolak
[değiştir | kaynağı değiştir]
Ventral tegmental alan
- Ventral tegmental alan (VTA), bir ödülün varlığını gösteren uyaranlara ve ipuçlarına yanıt vermede önemlidir. Ödüllendirici uyaranlar (ve tüm bağımlılık yapan ilaçlar) ödül devresine, nükleus akumbense dopamin sinyalleri salması için VTA'yı doğrudan ya da dolaylı olarak tetikleyerek etki eder. VTA'dan çıkan projeksiyonların iki önemli yolu vardır: Limbik (striatal) bölgelere giden, motivasyonel davranış ve süreçleri destekleyen mezolimbik yol ve prefrontal kortekse giden, dışsal ipuçlarını öğrenmek gibi bilişsel işlevleri destekleyen mezokortikal yol.[26]
- Bu bölgedeki dopaminerjik nöronlar, tirozin hidroksilaz enzimini kullanarak tirozin aminoasitini DOPA'ya dönüştürür ve daha sonra DOPA, dopa-dekarboksilaz enzimi kullanılarak dopamine dönüştürülür.[27]
Striatum
- Striatum, ödüllendirici bir ipucuna yanıt olarak öğrenilmiş davranışların edinilmesinde ve ortaya çıkarılmasında yer alır. VTA striatuma projeksiyon yapar; ventral (nükleus akumbens) ve dorsal striatumdaki D1 ve D2 reseptörleri aracılığıyla GABAerjik orta boy dikensi nöronları aktive eder.[28]
- Ventral Striatum (nükleus akumbens), VTA tarafından beslendiğinde davranış edinme ve prefrontal korteks (PFK) tarafından beslendiğinde davranışı ortaya çıkarmada görev alır. NAc kabuk bölgesi (NAc shell), limbik ve otonomik işlevleri düzenlemek üzere palidum ve VTA'ya projeksiyon yapar. Bu, uyaranların pekiştirici özelliklerini ve ödülün kısa vadedeki özelliklerini modüle eder. NAc kor bölgesi (NAc core), substantia nigraya projeksiyon yapar; ödül arama davranışlarının gelişmesinde ve ifade edilmesinde yer alır. Bu bölge aynı zamanda ödülün uzun vadedeki etkileri olan uzamsal öğrenme, koşullu tepki ve dürtüsel seçim ile ilgilidir.[26]
- Dorsal Striatum öğrenmede görev alır; Dorsal Medial Striatum hedefe yönelik öğrenmede görev alırken Dorsal Lateral Striatum, uyaran-tepki (stimulus-response) öğrenmesinde Pavlov tepkisinin temelini oluşturur.[29] Aynı uyaran tarafından tekrarlı aktivasyonda NAc, bir intrastriatal döngü yoluyla Dorsal Striatumu (DS) aktive edebilir. Sinyallerin NAc'den DS'ye geçişi, ödülle ilişkili ipuçlarının, ödülün kendisi mevcut olmadan DS'yi etkinleştirmesine izin verir. Bu, istekleri ve ödül arama davranışlarını harekete geçirebilir (ve bağımlılıkta yoksunluk sırasında nüksetmeyi (relapse) tetiklemekten sorumludur).[30]
Prefrontal korteks
- VTA'daki dopaminerjik nöronlar PFK'ye projeksiyon yapar, PFK'den Dorsal Striatum ve NAc dahil olmak üzere diğer birçok bölgeye projeksiyon yapan glutamaterjik nöronları aktive eder ve sonuçta PFK'nin uyaranlara yanıt olarak dikkat oluşumuna (salience) ve koşullu davranışlara aracılık etmesine izin verir.[30]
- Özellikle, bağımlılık yapan ilaçlardan uzak durma PFK'yi -bu bölgeden NAc'ye olan glutamaterjik projeksiyonları- aktive eder ve bu da yoksunluktan kaynaklanan bağımlılık davranışlarının yeniden ortaya çıkmasını modüle eder. PFC ayrıca mezokortikal yol aracılığıyla VTA ile etkileşime girer ve çevresel ipuçlarını ödülle ilişkilendirmeye yardımcı olur.[30]
Hipokampus
- Hipokampus, belleğin yaratılması ve saklanması da dahil olmak üzere birçok işleve sahiptir. Ödül devresinde, bağlamsal anılara ve ilgili ipuçlarına hizmet eder. Sonuç olarak, ipuçları ve bağlamsal tetikleyiciler aracılığıyla ödül arama davranışlarının yeniden ortaya çıkarılmasının temelini oluşturur.[31]
Amigdala (AMY)
- AMY, VTA'dan girdi alır ve NAc'ye çıktı verir. Amigdala, güçlü duygusal flaş bellek yaratımında önemlidir ve muhtemelen ipucuyla ilişkili (cue-associated) güçlü hatıraların yaratılmasının temelini oluşturur.[32] Ayrıca, yoksunluğun getirdiği kaygı etkilerine aracılık etmede ve bağımlılıkta artan ilaç alımında önemlidir.[33]
Haz merkezleri
[değiştir | kaynağı değiştir]Haz, ödülün bir bileşenidir, ancak tüm ödüller zevkli değildir (örneğin, şartlanma yoluyla bu tepki oluşmadıkça, para zevk getirmez).[1] Doğal olarak haz veren ve dolayısıyla çekici olan uyaranlar içsel ödüller olarak bilinirken; çekici ve yaklaşma davranışına güdüleyen, ancak doğal olarak zevkli olmayan uyaranlar dışsal ödüller olarak adlandırılır.[1] Dışsal ödüller (örn. para), içsel bir ödülle bir çağrışımın öğrenilmesi sonucunda ödüllendirici olur.[1] Başka bir deyişle, dışsal ödüller, elde edildikten sonra "beğenme" değil de "isteme" tepkilerini ortaya çıkaran motivasyonel mıknatıslar olarak işlev görür.[1]
Ödül sistemi haz merkezleri veya hedonik sıcak noktalar içerir – yani, içsel ödüllerden gelen zevk veya "beğenme" tepkilerine aracılık eden beyin yapıları. Ekim 2017 itibarıyla hedonik sıcak noktalar, nükleus akumbens kabuk bölgesi, ventral palidum, parabrakiyal nükleus, orbitofrontal korteks (OFK) ve insular korteks içindeki belli alt kısımlar olarak belirlenmiştir.Kaynak hatası: Açılış <ref> etiketi hatalı biçimlendirilmiş veya hatalı bir ada sahip (Bkz: Kaynak gösterme)[34] Nükleus akumbens kabuğundaki sıcak nokta, orta kabuğun rostrodorsal çeyreğinde bulunurken, hedonik soğuk nokta daha arka (posterior) bir bölgede bulunur. Posterior ventral palidum da bir hedonik sıcak nokta içerirken, ön (anterior) ventral palidum bir hedonik soğuk nokta içerir. Opioid, endokannabinoid ve oreksin mikroenjeksiyonları, bu sıcak noktalarda "beğeniyi" artırabilir.[1] Ön OFK ve arka insulada yer alan hedonik sıcak noktalar ile arka OFK ve ön insula (bu iki bölgedeki belli kısımları kapsayacak şekilde) bölgesinde bulunan bir hedonik soğuk bölgenin, oreksin ve opioid uyaranlarına yanıt verdiği gösterilmiştir.[34] Öte yandan parabrakiyal nükleustaki sıcak noktaların yalnızca benzodiazepin reseptör agonistlerine yanıt verdiği gösterilmiştir.[1]
Hedonik sıcak noktalar işlevsel olarak bağlantılıdır, çünkü bir sıcak noktanın aktivasyonu, diğer sıcak noktalarda da bu uyarıya ilk yanıt veren genlerden (immediate early gene) olan c-Fos'un indüklenmiş ifadesiyle sonuçlanır. Ayrıca, bir etkin noktanın inhibisyonu, başka bir etkin noktanın etkinleştirilmesiyle oluşan etkilerin körelmesine neden olur.[2][34] Bu nedenle, ödül sistemindeki her hedonik etkin noktanın eşzamanlı aktivasyonunun, yoğun bir öfori hissi yaratmak için gerekli olduğuna inanılmaktadır.Kaynak hatası: Açılış <ref> etiketi hatalı biçimlendirilmiş veya hatalı bir ada sahip (Bkz: Kaynak gösterme)
İsteme ve Beğenme
[değiştir | kaynağı değiştir]
Teşvik edicilik; NAc kabuk bölgesi tarafından ödüllendirici bir uyarana atanan, motivasyonel bir bileşen içeren "istemek" veya "arzulamak" niteliğidir.[1][1][11] Mezolimbik yoldan NAc kabuğuna dopamin nörotransmisyonunun (dopamin moleküllerinin post-sinaptik nörondaki reseptörlerine bağlanması) derecesi, ödüllendirici uyaranlara yönelik teşvik ediciliğin büyüklüğü ile yüksek oranda ilişkilidir.[1]
NAc'nin dorsorostral bölgesinin aktivasyonu, beğenmede artış olmaksızın istemedeki artışlarla ilişkilidir.[35] Bununla birlikte, NAc kabuk bölgesine dopaminerjik nörotransmisyon, yalnızca ödüllendirici uyaranlara yönelik iştah belirten motivasyonel davranışlardan (yani teşvik edicilikten) değil, aynı zamanda davranışı istenmeyen uyaranlardan uzaklaştıran caydırıcı motivasyonlardan da sorumludur.[7][36][37] Dorsal striatumda D1 ifade eden (express) orta boy dikensi nöronların aktivasyonu iştah belirten bir teşvik edicilik üretirken; D2 ifade eden orta boy dikensi nöronların aktivasyonu isteksizlik üretir. NAc'de, böyle bir ikilik o kadar net değildir ve hem D1 hem de D2 ifade eden orta boy dikensi nöronların aktivasyonu motivasyonu artırmak için yeterlidir,[38][39] bunun sebebi de muhtemelen D1 veya D2 aktivasyonuyla ventral pallidumun inhibe edilerek VTA'nın disinhibe edilmesidir.[40][41]
Robinson ve Berridge'in 1993'te önerdikleri teşvik-duyarlılaştırma (incentive-sensitization) teorisi, ödülün "istemek" (teşvik edilmek) ve "beğenmek" (haz) olarak iki farklı psikolojik bileşeninin olduğunu öne sürmüştür. Çikolata gibi belirli bir uyaranla kurulan temasın zamanla artmasını (zamanla daha çok çikolata yenmesi) açıklamak için, iş başında iki bağımsız faktör vardır - çikolataya sahip olma arzumuz (istek) ve çikolatanın verdiği haz (beğenme). Robinson ve Berridge'e göre, istemek ve beğenmek aynı sürecin iki yönüdür, bu nedenle ödüller genellikle aynı derecede istenir ve sevilir. Ancak isteme ve beğenme de belirli koşullar altında bağımsız olarak değişir. Örneğin, dopamin aldıktan sonra yemek yemeyen (yiyecek arzusunu yitiren) fareler, yiyecekleri hala seviyormuş gibi davranırlar. Başka bir örnekte, farelerin lateral hipotalamusunda kendi-kendini uyarma işlemi için kullanılan elektrotların aktivasyonu iştahı arttırır, ancak aynı zamanda şeker ve tuz gibi tatlara karşı daha olumsuz reaksiyonlara neden olur; görünüşe göre, uyarım beğenme'yi değil de isteme'yi artırıyor. Bu tür sonuçlar sıçanların ödül sisteminin, birbirinden bağımsız isteme ve beğenme süreçleri içerdiğini göstermektedir. İsteme bileşeninin dopaminerjik yolaklar tarafından kontrol edildiği düşünülürken, beğenme bileşeninin opiat-benzodiazepin sistemleri tarafından kontrol edildiği düşünülmektedir.[3]
Ödül Karşıtı (Anti-Reward) Sistem
[değiştir | kaynağı değiştir]Koobs ve Le Moal, ödül peşinde koşma davranışının zayıflamasından sorumlu olan ve ödül karşıtı devre olarak adlandırdıkları ayrı bir devre olduğunu öne sürdüler. Bu bileşen ödül devresinde fren görevi görür, böylece aşırı yiyecek, seks vb. peşinde koşmayı önler. Bu devre, amigdalanın birden fazla kısmını (stria terminalinin yatak çekirdeği, merkezi çekirdek), NAc'yi ve norepinefrin, kortikotropin salıcı faktör ve dynorphin dahil olmak üzere bazı sinyal moleküllerini içerir.[42] Bu devrenin aynı zamanda stresin hoş olmayan bileşenlerine aracılık ettiği varsayılır ve bu nedenle bağımlılık ve yoksunluk (withdrawal) belirtilerinde rolü olduğu düşünülür. Ödül devresi, bağımlılığın gelişim evresindeki olumlu pekiştirmeye aracılık ederken, daha sonra olumsuz pekiştirme yoluyla ödüllendirici uyaranların peşinde koşmayı motive edip hakimiyeti alan devre, ödül karşıtı devredir.[43]
Ödül Sisteminin Öğrenmeyle İlişkisi
[değiştir | kaynağı değiştir]Ödüllendirici uyaranlar öğrenmeyi hem klasik koşullanma (Pavlovyan koşullanma) hem de edimsel koşullama (araçsal koşullanma) formunda sağlayabilir. Klasik koşullanmada, bir ödül, koşullu uyarıcı ile ilişkilendirildiğinde, koşullu uyarıcının hem kas-iskelet sistemini (basit yaklaşma ve kaçınma davranışları biçiminde) hem de bitkisel tepkileri ortaya çıkarmasına neden olan koşulsuz bir uyarıcı olarak görev alabilir. Edimsel koşullanmada, bir ödül, kendisine yol açan eylemleri arttırdığı veya desteklediği için bir güçlendirici olarak hareket edebilir.[44] Öğrenilmiş davranışlar, yol açtıkları sonuçların değerine (sonucun olumlu ya da olumsuz oluşuna) duyarlı olabilir veya olmayabilir: Belli bir sonucun, bir eylemin gerçekleşmesine bağlı olması (eylemin bir sonuca duyarlı olması) ve bu eylemin sonuç değerine duyarlı olması durumunda o eylem hedefe yöneliktir; sonucun değerine karşı duyarsız olan eylemlere ise alışkanlık denir. Bu ayrımın, modelsiz ve model temelli olmak üzere iki öğrenme biçimini yansıttığı düşünülmektedir. Modelsiz öğrenme, değerlerin basit bir şekilde önbelleğe alınmasını (caching) ve güncellenmesini içerir. Buna karşılık, model tabanlı öğrenme, çıkarsama ve esnek tahmine izin veren dahili bir olay modelinin depolanmasını ve oluşturulmasını içerir. Pavlovyan koşullanmanın genellikle modelsiz öğrenme olduğu varsayılsa da, koşullu bir uyarana atanan teşvik edicilik, içsel motivasyon durumlarındaki değişiklikler açısından esnektir.[45]
Uyaranlar ve sonuçlar, eylemler ve sonuçlar ve uyaranlar ve tepkiler arasındaki ilişkileri öğrenmekten sorumlu olan nöral sistemler birbirinden farklıdır. Klasik koşullanma ödül sistemi ile sınırlı olmamakla birlikte, koşullu uyaranlarla edimsel koşullamadaki performansın arttırılması (yani Pavlovyan-araçsal aktarım) nükleus akumbensi gerektirir. Alışkanlık ve hedefe yönelik edimsel öğrenme, sırasıyla lateral ve medial striatuma bağlıdır.[46]
Edimsel öğrenme sırasında; sırasıyla direkt ve indirekt yolağı oluşturan D1 ve D2 tipi orta boy dikensi nöronlarda, AMPA ve NMDA reseptörlerinin oranları ve fosforile olmuş ERK proteini miktarları bakımından zıt yönlü değişimler olur.[47][48] Sinaptik plastisitedeki bu değişiklikler ve beraberindeki öğrenme, striatumdaki D1 ve NMDA reseptörlerinin aktivasyonuna bağlıdır. D1 reseptörleri tarafından aktive edilen hücre içi kaskadı, protein kinaz A'nın işlevselleşmesi ve sonuçta DARPP-32'nin fosforilasyonu yoluyla, ERK'yi deaktive eden fosfatazların inhibisyonunu içerir. NMDA reseptörleri, farklı fakat birbiriyle ilişkili bir Ras-Raf-MEK-ERK yolağı aracılığıyla ERK'yi aktive eder . NMDA aktivasyonu aynı zamanda ERK deaktive edici fosfatazların PKA-aracılı inhibisyonunu da inhibe ettiğinden, ERK'nin tek başına NMDA aracılı aktivasyonu sınırlanmaktadır (Özetle NMDA aktivasyonu ERK'yi aynı anda hem aktive hem de deaktive etmektedir). Fakat D1 ve NMDA kaskadları aynı anda aktif olduğunda sinerji içerisinde çalışırlar ve sonuçta aktive olan ERK; dendritik dikenlerin (dendritic spine) yeniden yapılandırılması, AMPA reseptörlerinin taşınması, CREB proteininin düzenlenmesi ve Kv4.2'nin inhibe edilmesi yoluyla nöronun uyarılabilirliğini (excitability) artırma yöntemleri ile sinaptik plastisiteyi düzenlemektedir.[49][50][51]
Ödül Sistemi ile İlgili Bozukluklar
[değiştir | kaynağı değiştir]Bağımlılık
[değiştir | kaynağı değiştir]ΔFosB (DeltaFosB)'nin - Bir transkripsiyon faktörü - nükleus akumbensteki D1 tipi orta boy dikensi nöronlardaki aşırı ifadesi (overexpression), bağımlılığın hemen hemen tüm çeşitlerinde gözüken (örneğin davranışsal bağımlılıklar ve ilaç bağımlılığı) kritik bir durumdur.[52][53][54] ΔFosB özellikle kendi kendine (ilaç, uyuşturucu vb.) kullanma, ödüle duyarlılığın artması ve bağımlılık yapan ilaç ve davranışların birbirlerine olan duyarlılığı artırması (bağımlılık yapan ilaçtan birinin kullanımının, kişinin diğer ilaca olan duyarlılığını artırması gibi) etkilerini güçlendirir.[53][55][56] Beynin belirli bölgelerindeki histon proteinlerinin kuyruk kısımlarındaki belirli epigenetik modifikasyonların, bağımlılıkların moleküler temelinde çok önemli bir rol oynadığı da bilinmektedir.[54][57][58][59]
Bağımlılık yapan uyuşturucular ve davranışlar, dopamin ödül yolağı üzerindeki etkileri nedeniyle ödüllendirici ve pekiştiricidir (yani bağımlılık yapar).[60][61]
Lateral hipotalamus ve medial ön beyin demeti, özellikle ilaçların beyin stimülasyonu ödülü üzerindeki etkilerine ilişkin çalışmalarda, en sık çalışılan bölgeler olmuştur.[62] Kötüye kullanılan ilaçların alışkanlık oluşturan etkilerinin altında yatan nörotransmiter sistemi, nükleus akumbense giden nöronlar ve yerel GABAerjik nöronlardan aldığı girdilerden oluşan mezolimbik dopamin sistemidir. Amfetamin ve kokainin beyinde ödülle ilişkili etkileri, nükleus akumbensin dopaminerjik sinapslarında ve bir ihtimal medial prefrontal kortekstedir. Sıçanlar ayrıca, medial prefrontal kortekse kokain enjeksiyonu almak için (bu enjeksiyon, nükleus akumbenste dopaminin devir hızını artırır) bir kaldıraca bastırmayı da öğrenirler.[63][64] Doğrudan nükleus akumbense verilen nikotin de, muhtemelen bu bölgenin dopaminerjik terminalleri üzerindeki presinaptik bir etki ile lokal dopamin salınımını arttırır. Nikotinik reseptörler dopaminerjik hücrelerin gövdelerine lokalize olur ve lokal nikotin enjeksiyonları, nikotinik ödül için kritik olan dopaminerjik hücre ateşlemesini arttırır.[65][66] Opiatlarda ise, ödül etkilerinin görülmesi için en düşük eşiğe sahip bölge VTA'dır ve ödül etkisini oluşturan da buradaki GABAerjik nöronların aktivitesidir. Opiatlar ayrıca nükleus akumbensteki orta boy dikensi nöronları (bir sonraki cümle için bu nöronların GABAerjik olduklarını hatırlamakta fayda var) etkiler. Yani, şu ana kadar karakterize edilebilen ilaç-ödül devresi şunları içerir: Mezolimbik dopamin nöronlarına GABAerjik projeksiyonlar (opiatların ödül etkisinin birincil substratı), mezolimbik dopamin nöronlarının kendisi (psikomotor uyaranlara dayalı ödüllerin birincil substratı) ve mezolimbik dopamin nöronlarının GABAerjik eferentleri (önceki cümlede bahsedilen nükleus akumbensteki orta boy dikensi nöronlar).[62]
Motivasyon
[değiştir | kaynağı değiştir]İşlevselliği engelleyici motivasyonel bozukluklar, bir dizi psikiyatrik semptom ve bozuklukta ortaya çıkar. Geleneksel olarak zevk hissetme kapasitesinin azalması olarak tanımlanan anhedoninin, çoğu anhedonik popülasyonda "beğenme" davranışları azalmadığı için aslında teşvik edilmedeki azalmayı yansıttığı düşünülmüş ve bu yüzden anhedoni yeniden incelenmiştir.[67][68] Spektrumun diğer ucunda, yalnızca belirli uyaranların teşvik edici olması, davranışsal ve uyuşturucu bağımlılıklarının özelliğidir. Korku ya da paranoya durumunda, kişinin işlevselliği kaybetmesinin altında uyaranların sebep olduğu caydırıcılığın (tiksinme) artması yatıyor olabilir.[69]
Anhedonia ile ilişkili tanılar konmuş bireylerde yapılan beyin görüntüleme çalışmaları, OFC ve ventral striatumda aktivitenin azaldığını bildirmiştir.[70] Bir meta analiz de; anhedoninin kaudat nükleus, putamen, nükleus akumbens ve medial prefrontal korteks (mPFC) bölgelerinde ödül beklentisine verilen tepkinin azalmasıyla ilişkili olduğunu bildirmiştir.[71]
Duygudurum bozuklukları
[değiştir | kaynağı değiştir]Ödül için çaba harcama istekliliği ile değerlendirildiği üzere, belirli depresyon türleri düşük motivasyonla ilişkilidir. Bu anormallikler kesin olmamakla birlikte striatumun belli bölgelerindeki azalmış aktivite ile bağlantılıdır ve dopaminerjik anormalliklerin bu durumda bir rol oynadığı varsayılırken, depresyonda dopamin fonksiyonunu araştıran çalışmalar tutarsız sonuçlar bildirmiştir.[72][73] Postmortem ve nörogörüntüleme çalışmaları ödül sisteminin birçok bölgesinde anormallikler bulmuş olsa da, sadece birkaç bulgu tutarlı bir şekilde tekrarlanabilmiştir. Bazı çalışmalar, ödül veya pozitif uyaranlarla ilgili görevler sırasında NAc, hipokampus, mPFC ve OFC aktivitesinin azaldığını ve bazolateral amigdala ile subgenual singulat korteks (sgACC) aktivitesinin arttığını bildirmiştir. Bu anormalliklerin görüldüğü beyin görüntüleme çalışmalarını, az sayıda postmortem araştırma tamamlamaktadır; yapılan bu araştırmalar, mPFC'deki uyarıcı (excitatory) sinapsların azaldığını göstermektedir.[74] Ödülle ilgili görevler sırasında mPFC'deki azalmış aktivite, daha fazla dorsal bölgeye (yani pregenual singulat korteks (pgACC)) lokalize oluyor gibi görünürken, daha ventral sgACC ise depresyonda normalden aktif olmaktadır.[75]
Bu anormalliklerin altında yatan nöral devreleri hayvan modellerinde araştırma girişimleri de çelişkili sonuçlar vermiştir. Hayvanlarda depresyonu simüle etmek için kullanılan en yaygın iki model; kronik sosyal yenilgi stresi (KSYS) ve kronik hafif stres (KHS) modelidir. Bu modeller; sükroz tercihinde ve sosyal etkileşimde azalma ile zorunlu yüzme testinde hareketsizliğin artması (davranışsal çaresizlik) gibi hayvanlarda depresyonla ilişkilendirilen endofenotipler üretmektedir. KSYS'ye duyarlı hayvanlarda, fazik VTA ateşlemesinde artış görülür ve VTA-NAc projeksiyonlarının inhibisyonu, KSYS'nin neden olduğu davranışsal semptomları azaltır.[76] Bununla birlikte, VTA- mPFC projeksiyonlarının inhibisyonu, sosyal geri çekilmeyi (social withdrawal) şiddetlendirir. Öte yandan, sükroz tercihinde ve zorunlu yüzme testinde görülen hareketsizlikte KHS ile ilişkili değişimler (sırasıyla azalma ve artış), VTA uyarımı ve inhibisyonu ile sırasıyla iyileştirilmiş ve şiddetlendirilmiştir.[18][77] Bu farklılıklar, farklı stimülasyon protokollerine veya zayıf translasyonel paradigmalara atfedilebilir olsa da, bu değişken sonuçların sebebi ödülle ilgili bölgelerin işlevlerindeki heterojenlik de olabilir.[78]
mPFC'nin tamamının optogenetik uyarımı, antidepresan etkiler üretir. Bu etkinin aslında, pgACC'nin kemirgenlerdeki homoloğunda (prelimbik korteks) lokalize olduğu görünüyor, çünkü sgACC'nin kemirgen homoloğunun (infralimbik korteks) uyarılması hiçbir davranışsal etki üretmiyor. Ayrıca inhibitör etkisi olduğu düşünülen infralimbik korteksin derin beyin stimülasyonu yöntemiyle uyarılması da antidepresan etki yaratır. Bu bulgu, infralimbik korteksin farmakolojik inhibisyonunun depresif davranışları azalttığı gözlemiyle uyumludur.[78]
Şizofreni
[değiştir | kaynağı değiştir]Şizofreni, doğaçlama konuşmanın azalması gibi negatif semptomlarla gözlendiği üzere motivasyonda azalmalarla ilişkilendirilir . "Beğenme" deneyiminin hem nöral hem de davranışsal açıdan genellikle aynı kaldığı rapor edilmiştir, fakat bu sonuçlar para ödülleri gibi yalnızca belli başlı uyaranlara özgü de olabilir.[79][80] Ayrıca, şizofrenide örtük öğrenme ve ödülle ilgili basit görevlerde de bozulma görülmemektedir.[80] Aksine, ödül sistemindeki eksiklikler, bilişsel olarak karmaşık olan ödülle ilgili görevler sırasında belirgindir. Bu eksiklikler striatum ve OFK'deki anormal aktiviteyle, bir de dorsolateral prefrontal korteks (DLPFC) gibi bilişsel işlevlerle ilişkili bölgelerdeki anormalliklerle ilişkilidir. [80]
Dikkat eksikliği hiperaktivite bozukluğu (DEHB)
[değiştir | kaynağı değiştir]DEHB hastalarında, ödül sisteminin temel kısımları normalden daha az aktiftir ve bu durum hastaların düzenli faaliyetlerden ödül almasını zorlaştırır. Bozukluğu olanlar, yüksek seviyede uyarıcı bir davranış dopamin salınımını tetikledikten sonra bir motivasyon artışı yaşarlar. Bu destek ve ödülün ardından, dopaminin eski seviyelere dönüşü, motivasyonda ani bir düşüşe neden olur.[81]
Dopaminerjik ve serotonerjik fonksiyon bozukluklarının DEHB'de ana faktörler olduğu söylenmektedir.[82] Bu bozukluklar, ödül işleme (reward processing) gibi yürütücü işlevler problemleri ve anhedoni gibi motivasyonel işlev bozukluklarına yol açabilir.[83]
Ödül Sistemi ile İlgili Buluşların Tarihi
[değiştir | kaynağı değiştir]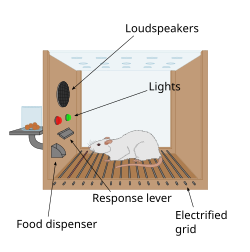
Beyinde bir ödül sisteminin varlığına dair ilk ipucu, 1954'te James Olds ve Peter Milner tarafından kazara yapılan bir keşifle geldi. Sıçanların, beyinlerindeki belirli bölgelere kısa süreli bir elektrik stimülasyonu uygulamak için bir çubuğa basmak gibi davranışlar sergilediklerini keşfettiler. Bu fenomene intrakraniyal kendi kendini uyarma veya beyin stimülasyonu ödülü denir. Tipik olarak, fareler bu beyin stimülasyonunu elde etmek için bir kola saatte yüzlerce veya binlerce kez basarlar ve yalnızca tükendiklerinde dururlar. Sıçanlara problem çözmeyi ve labirentlerde ilerlemeyi öğretmeye çalışırken, beyinde önceki çalışmada bahsedilen bölgelerin uyarılması hayvanlara zevk veriyor gibiydi. Aynı şeyi insanlarda da denediler ve sonuçlar benzerdi. Hayvanların neden kendilerinin veya türlerinin hayatta kalması için hiçbir değeri olmayan bir davranışta (intrakraniyal kendi kendini uyarma) bulunduğunun açıklaması, bu uyarımın beyindeki ödül sistemini harekete geçirmesidir.[84]
1954'te yapılan temel bir keşifte James Olds ve Peter Milner, farelerin beyninin belirli bölgelerinin düşük voltajlı elektrikle uyarılmasının, hayvanlara labirentlerde ilerlemeyi ve problem çözmeyi öğretmede bir ödül olarak kullanılabildiğini buldular.[85][86] Beynin bu bölümlerinin uyarılmasının hayvanlara zevk verdiği görülüyordu[85] ve daha sonraki çalışmalarda insanlar bu tür uyaranlar karşısında haz verici duyumlar bildirdiler. Sıçanlar, bir kola basarak ödül sistemini uyarabilecekleri Skinner kutularında test edildiğinde, o kola saatlerce bastırdılar.[86] Sonraki yirmi yılda yapılan araştırmalar, dopaminin bu bölgelerde nöral sinyalleşmeye yardımcı olan ana kimyasallardan biri olduğunu ve dopaminin beynin "zevk kimyasalı" olduğunu öne sürdü.[87]
Ivan Pavlov , klasik koşullanmayı incelemek için ödül sistemini kullanan bir psikologdu. Pavlov bu sistemi, köpekleri bir zil veya başka bir uyaranla uyardıktan sonra yiyecekle ödüllendirerek kullanıyordu. Pavlov köpekleri ödüllendiriyordu, böylece köpekler yemeği, yani ödülü; zil ile, yani uyarıcıyla ilişkilendiriyordu.[88] Edward L. Thorndike, edimsel koşullanmayı incelemek için ödül sistemini kullanıyordu. Kedileri bir bulmaca kutusuna koyardı ve yemeği kutunun dışına koyduğu için kediler kutudan kaçmak isterlerdi. Kediler kutudan kaçtıktan sonra mamayı yemelerine rağmen, Thorndike kedilerin mama ödülü olmadan da kutudan kaçmaya çalıştıklarını gördü. Thorndike, kedilerin ödül sistemini uyarmak için yiyecek ve özgürlüğün ödüllerini kullandı.[89]
Diğer Türler
[değiştir | kaynağı değiştir]Hayvanlar, doğrudan (tegmentuma veya nükleus akumbense) bir afyon enjeksiyonu elde etmek için bir çubuğa basmayı çabukça öğrenirler. Aynı hayvanlar, mezolimbik yolun dopaminerjik nöronları etkisiz hale getirilirse afyon elde etmek için çalışmazlar. Bu perspektifte, hayvanlar da insanlar gibi dopamin salınımını artıran davranışlarda bulunurlar.
Bir afektif sinirbilim araştırmacısı olan Kent Berridge, tatlı ve acı tatların farklı ağız-yüz ifadeleri üretttiğini ve bu ifadelerin yeni doğan insanlar, orangutanlar ve sıçanlarda benzer şekilde üretildiğini buldu. Bu, hazzın (özellikle hoşlanmanın) nesnel özelliklere sahip olduğunun ve çeşitli hayvan türlerinde esasen aynı olduğunun kanıtıydı. Çoğu sinirbilim araştırması, ödül sayesinde ne kadar çok dopamin salınırsa, ödülün o kadar etkili olduğunu göstermiştir. Buna, ödül için harcanan çaba ve ödülün kendisi tarafından değiştirilebilen hedonik etki denir. Berridge, dopamin sistemlerinin bloke edilmesinin, tatlı bir şeye verilen pozitif tepkiyi değiştirmediğini keşfetti (yüz ifadesi ile ölçüldüğü üzere). Başka bir deyişle, hedonik etki şeker miktarına göre değişmedi. Bu, dopaminin hazza aracılık ettiğine dair geleneksel varsayımı yanlışladı. Daha yoğun dopamin değişiklikleriyle bile, veriler reaksiyonların seviyesi sabit kalıyor gibiydi.[90] Bununla birlikte, bir dopamin öncüsünün (levodopa), antagonistin (risperidon) ve plasebonun müziğe verilen ödül tepkileri -elektrodermal aktivitedeki değişiklikler ve müzik ile rahatlama seansları sırasında sübjektif derecelendirmelerle ölçülen zevk derecesi- üzerindeki etkisini değerlendiren Ocak 2019 tarihli bir klinik çalışma, dopamin nörotransmisyonu manipülasyonlarının, insan deneklerde haz bilişini (özellikle müziğin hedonik etkisini) çift yönlü olarak düzenlediğini buldu.[91][92] Bu araştırma, artan dopamin nörotransmisyonunun, insanlarda müziğe verilen hedonik tepkiler için olmazsa olmaz bir koşul olarak etki gösterdiğini bulmuştur.[91][92]
Berridge, ödülün "isteme" boyutunu açıklamak adına teşvik edicilik (incentive salience) hipotezini geliştirmiştir. Uyuşturucu artık öfori üretmediğinde bile uyuşturucu bağımlıları tarafından uyuşturucuların kompulsif kullanımını ve bireyin yoksunluktan geçtikten sonra bile yaşadığı şiddetli istekleri açıklar. Bazı bağımlılar, uyuşturucuların neden olduğu sinirsel değişikliklere sebep olan belirli başka uyaranlara yanıt verir. Beyindeki bu duyarlılaşma, dopaminin yarattığı etkiye benzer çünkü isteme ve beğenme tepkileri oluşur. İnsan ve hayvan beyinleri ve davranışları, ödül sistemleriyle ilgili olarak benzer değişiklikler yaşar çünkü bu sistemler çok belirgindir.[90]
Kaynakça
[değiştir | kaynağı değiştir]- ^ a b c d e f g h i j k l m n o p q r s t u v w x Schultz, Wolfram (1 Temmuz 2015). "Neuronal Reward and Decision Signals: From Theories to Data". Physiological Reviews. 95 (3): 853-951. doi:10.1152/physrev.00023.2014. ISSN 0031-9333. PMC 4491543 $2. PMID 26109341. 3 Eylül 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2021.
- ^ a b c Berridge, Kent C.; Kringelbach, Morten L. (Mayıs 2015). "Pleasure Systems in the Brain". Neuron. 86 (3): 646-664. doi:10.1016/j.neuron.2015.02.018. ISSN 0896-6273. PMC 4425246 $2. PMID 25950633.
- ^ a b c d e An Introduction to Brain and Behavior. 1st. New York: Worth. 2001. ss. 438-441. ISBN 9780716751694.
- ^ "The Biology of Addiction". YouTube. 13 Mart 2019. 19 Ocak 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2021.
- ^ "Dopamine Involved In Aggression". web.archive.org. 23 Eylül 2010. 23 Eylül 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Ağustos 2021.
- ^ Duarte (1 Mayıs 2017). "Tribal love: the neural correlates of passionate engagement in football fans". Social Cognitive and Affective Neuroscience. 12 (5): 718-728. doi:10.1093/scan/nsx003. PMC 5460049 $2. PMID 28338882.
- ^ a b c Salamone (November 2012). "The Mysterious Motivational Functions of Mesolimbic Dopamine". Neuron. 76 (3): 470-485. doi:10.1016/j.neuron.2012.10.021. PMC 4450094 $2. PMID 23141060.
- ^ a b c d e f g "The ins and outs of the striatum: Role in drug addiction". Neuroscience. 301: 529-541. August 2015. doi:10.1016/j.neuroscience.2015.06.033. PMC 4523218 $2. PMID 26116518.
[The striatum] receives dopaminergic inputs from the ventral tegmental area (VTA) and the substantia nigra (SNr) and glutamatergic inputs from several areas, including the cortex, hippocampus, amygdala, and thalamus (Swanson, 1982; Phillipson and Griffiths, 1985; Finch, 1996; Groenewegen et al., 1999; Britt et al., 2012). These glutamatergic inputs make contact on the heads of dendritic spines of the striatal GABAergic medium spiny projection neurons (MSNs) whereas dopaminergic inputs synapse onto the spine neck, allowing for an important and complex interaction between these two inputs in modulation of MSN activity ... It should also be noted that there is a small population of neurons in the [nucleus accumbens] NAc that coexpress both D1 and D2 receptors, though this is largely restricted to the NAc shell (Bertran- Gonzalez et al., 2008). ... Neurons in the NAc core and NAc shell subdivisions also differ functionally. The NAc core is involved in the processing of conditioned stimuli whereas the NAc shell is more important in the processing of unconditioned stimuli; Classically, these two striatal MSN populations are thought to have opposing effects on basal ganglia output. Activation of the dMSNs causes a net excitation of the thalamus resulting in a positive cortical feedback loop; thereby acting as a 'go’ signal to initiate behavior. Activation of the iMSNs, however, causes a net inhibition of thalamic activity resulting in a negative cortical feedback loop and therefore serves as a 'brake’ to inhibit behavior ... there is also mounting evidence that iMSNs play a role in motivation and addiction (Lobo and Nestler, 2011; Grueter et al., 2013). For example, optogenetic activation of NAc core and shell iMSNs suppressed the development of a cocaine CPP whereas selective ablation of NAc core and shell iMSNs ... enhanced the development and the persistence of an amphetamine CPP (Durieux et al., 2009; Lobo et al., 2010). These findings suggest that iMSNs can bidirectionally modulate drug reward. ... Together these data suggest that iMSNs normally act to restrain drug-taking behavior and recruitment of these neurons may in fact be protective against the development of compulsive drug use.
- ^ "The neurocircuitry of illicit psychostimulant addiction: acute and chronic effects in humans". Subst Abuse Rehabil. 4: 29-43. 2013. doi:10.2147/SAR.S39684. PMC 3931688 $2. PMID 24648786.
Regions of the basal ganglia, which include the dorsal and ventral striatum, internal and external segments of the globus pallidus, subthalamic nucleus, and dopaminergic cell bodies in the substantia nigra, are highly implicated not only in fine motor control but also in [prefrontal cortex] PFC function.43 Of these regions, the [nucleus accumbens] NAc (described above) and the [dorsal striatum] DS (described below) are most frequently examined with respect to addiction. Thus, only a brief description of the modulatory role of the basal ganglia in addiction-relevant circuits will be mentioned here. The overall output of the basal ganglia is predominantly via the thalamus, which then projects back to the PFC to form cortico-striatal-thalamo-cortical (CSTC) loops. Three CSTC loops are proposed to modulate executive function, action selection, and behavioral inhibition. In the dorsolateral prefrontal circuit, the basal ganglia primarily modulate the identification and selection of goals, including rewards.44 The [orbitofrontal cortex] OFC circuit modulates decision-making and impulsivity, and the anterior cingulate circuit modulates the assessment of consequences.44 These circuits are modulated by dopaminergic inputs from the [ventral tegmental area] VTA to ultimately guide behaviors relevant to addiction, including the persistence and narrowing of the behavioral repertoire toward drug seeking, and continued drug use despite negative consequences.43–45
- ^ "The use of repetitive transcranial magnetic stimulation for modulating craving and addictive behaviours: A critical literature review of efficacy, technical and methodological considerations". Neuroscience & Biobehavioral Reviews (İngilizce). 47: 592-613. 1 Kasım 2014. doi:10.1016/j.neubiorev.2014.10.013. ISSN 0149-7634. 4 Eylül 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2021.
- ^ a b Nestler, Eric J. (2009). Molecular neuropharmacology : a foundation for clinical neuroscience. 2nd ed. Steven E. Hyman, Robert C. Malenka. New York: McGraw-Hill Medical. ISBN 978-0-07-164119-7. OCLC 273018757.
- ^ "Mapping brain circuits of reward and motivation: In the footsteps of Ann Kelley". Neuroscience & Biobehavioral Reviews (İngilizce). 37 (9): 1919-1931. 1 Kasım 2013. doi:10.1016/j.neubiorev.2012.12.008. ISSN 0149-7634. PMC 3706488 $2. PMID 23261404. 4 Eylül 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2021.
- ^ "Reward processing by the dorsal raphe nucleus: 5-HT and beyond". Learn. Mem. 22 (9): 452-460. August 2015. doi:10.1101/lm.037317.114. PMC 4561406 $2. PMID 26286655.
- ^ "The cerebellum and addiction: insights gained from neuroimaging research". Addict. Biol. 19 (3): 317-331. May 2014. doi:10.1111/adb.12101. PMC 4031616 $2. PMID 24851284.
- ^ "Consensus Paper: Towards a Systems-Level View of Cerebellar Function: the Interplay Between Cerebellum, Basal Ganglia, and Cortex". Cerebellum. 16 (1): 203-229. February 2017. doi:10.1007/s12311-016-0763-3. PMC 5243918 $2. PMID 26873754.
- ^ Ogawa (2018). "Organization of dopamine and serotonin system: Anatomical and functional mapping of monosynaptic inputs using rabies virus". Pharmacology Biochemistry and Behavior. 174: 9-22. doi:10.1016/j.pbb.2017.05.001. PMID 28476484.
- ^ Morales (February 2017). "Ventral tegmental area: cellular heterogeneity, connectivity and behaviour". Nature Reviews. Neuroscience. 18 (2): 73-85. doi:10.1038/nrn.2016.165. PMID 28053327.
- ^ a b Lammel (January 2014). "Reward and aversion in a heterogeneous midbrain dopamine system". Neuropharmacology. 76 Pt B: 351-9. doi:10.1016/j.neuropharm.2013.03.019. PMC 3778102 $2. PMID 23578393.
- ^ Nieh (20 Mayıs 2013). "Optogenetic dissection of neural circuits underlying emotional valence and motivated behaviors". Brain Research. 1511: 73-92. doi:10.1016/j.brainres.2012.11.001. PMC 4099056 $2. PMID 23142759.
- ^ "Mechanisms underlying differential D1 versus D2 dopamine receptor regulation of inhibition in prefrontal cortex". The Journal of Neuroscience. 24 (47): 10652-10659. 2004. doi:10.1523/jneurosci.3179-04.2004. PMC 5509068 $2. PMID 15564581.
- ^ "Dopamine and glutamate release in the nucleus accumbens and ventral tegmental area of rat following lateral hypothalamic self-stimulation". Neuroscience. 107 (4): 629-639. 2001. doi:10.1016/s0306-4522(01)00379-7. PMID 11720786.
- ^ a b Castro (2015). "Lateral hypothalamus, nucleus accumbens, and ventral pallidum roles in eating and hunger: interactions between homeostatic and reward circuitry". Frontiers in Systems Neuroscience. 9: 90. doi:10.3389/fnsys.2015.00090. PMC 4466441 $2. PMID 26124708.
- ^ Carlezon WA (2009). "Biological substrates of reward and aversion: a nucleus accumbens activity hypothesis". Neuropharmacology. 56 Suppl 1: 122-32. doi:10.1016/j.neuropharm.2008.06.075. PMC 2635333 $2. PMID 18675281.
- ^ "Brain dopamine and reward". Annual Review of Psychology. 40: 191-225. 1989. doi:10.1146/annurev.ps.40.020189.001203. PMID 2648975.
- ^ "Brain reward circuitry: insights from unsensed incentives". Neuron. 36 (2): 229-240. October 2002. doi:10.1016/S0896-6273(02)00965-0. PMID 12383779.
- ^ a b Kokane, S. S., & Perrotti, L. I. (2020). Sex Differences and the Role of Estradiol in Mesolimbic Reward Circuits and Vulnerability to Cocaine and Opiate Addiction. Frontiers in Behavioral Neuroscience, 14.
- ^ Becker, J. B., & Chartoff, E. (2019). Sex differences in neural mechanisms mediating reward and addiction. Neuropsychopharmacology, 44(1), 166-183.
- ^ Stoof, J. C., & Kebabian, J. W. (1984). Two dopamine receptors: biochemistry, physiology and pharmacology. Life sciences, 35(23), 2281-2296.
- ^ Yin, H. H., Knowlton, B. J., & Balleine, B. W. (2005). Blockade of NMDA receptors in the dorsomedial striatum prevents action–outcome learning in instrumental conditioning. European Journal of Neuroscience, 22(2), 505-512.
- ^ a b c Koob, G. F., & Volkow, N. D. (2016). Neurobiology of addiction: a neurocircuitry analysis. The Lancet Psychiatry, 3(8), 760-773.
- ^ Kutlu, M. G., & Gould, T. J. (2016). Effects of drugs of abuse on hippocampal plasticity and hippocampus-dependent learning and memory: contributions to development and maintenance of addiction. Learning & memory, 23(10), 515-533.
- ^ McGaugh, J. L. (July 2004). "The amygdala modulates the consolidation of memories of emotionally arousing experiences". Annual Review of Neuroscience. 27 (1): 1–28.
- ^ Koob G. F., Le Moal M. (2008). Addiction and the brain antireward system. Annu. Rev. Psychol. 59 29–53. 10.1146/annurev.psych.59.103006.093548 [PubMed] [CrossRef] [Google Scholar] Koob G. F., Sanna P. P., Bloom F. E. (1998). Neuroscience of addiction. Neuron 21 467–476.
- ^ a b c Castro (24 Ekim 2017). "Opioid and orexin hedonic hotspots in rat orbitofrontal cortex and insula". Proceedings of the National Academy of Sciences of the United States of America. 114 (43): E9125-E9134. doi:10.1073/pnas.1705753114. PMC 5664503 $2. PMID 29073109.
Here, we show that opioid or orexin stimulations in orbitofrontal cortex and insula causally enhance hedonic “liking” reactions to sweetness and find a third cortical site where the same neurochemical stimulations reduce positive hedonic impact.
- ^ "Neuroscience of affect: brain mechanisms of pleasure and displeasure". Current Opinion in Neurobiology. 23 (3): 294-303. 1 Haziran 2013. doi:10.1016/j.conb.2013.01.017. PMC 3644539 $2. PMID 23375169.
For instance, mesolimbic dopamine, probably the most popular brain neurotransmitter candidate for pleasure two decades ago, turns out not to cause pleasure or liking at all. Rather dopamine more selectively mediates a motivational process of incentive salience, which is a mechanism for wanting rewards but not for liking them .... Rather opioid stimulation has the special capacity to enhance liking only if the stimulation occurs within an anatomical hotspot
- ^ Calipari (8 Mart 2016). "In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward". Proceedings of the National Academy of Sciences. 113 (10): 2726-2731. doi:10.1073/pnas.1521238113. PMC 4791010 $2. PMID 26831103.
- ^ Baliki (9 Ekim 2013). "Parceling Human Accumbens into Putative Core and Shell Dissociates Encoding of Values for Reward and Pain". Journal of Neuroscience. 33 (41): 16383-16393. doi:10.1523/JNEUROSCI.1731-13.2013. PMC 3792469 $2. PMID 24107968.
- ^ Soares-Cunha (September 2016). "Reappraising striatal D1- and D2-neurons in reward and aversion". Neuroscience & Biobehavioral Reviews. 68: 370-386. doi:10.1016/j.neubiorev.2016.05.021. PMID 27235078.
- ^ Bamford (February 2018). "Dopamine's Effects on Corticostriatal Synapses during Reward-Based Behaviors". Neuron. 97 (3): 494-510. doi:10.1016/j.neuron.2018.01.006. PMC 5808590 $2. PMID 29420932.
- ^ Soares-Cunha (September 2016). "Activation of D2 dopamine receptor-expressing neurons in the nucleus accumbens increases motivation". Nature Communications. 7 (1): 11829. doi:10.1038/ncomms11829. PMC 4931006 $2. PMID 27337658.
- ^ Soares-Cunha (March 2018). "Nucleus Accumbens Microcircuit Underlying D2-MSN-Driven Increase in Motivation". eNeuro. 5 (2): ENEURO.0386-18.2018. doi:10.1523/ENEURO.0386-18.2018. PMC 5957524 $2. PMID 29780881.
- ^ Koob G. F., Le Moal M. (2008). Addiction and the brain antireward system. Annu. Rev. Psychol. 59 29–53. 10.1146/annurev.psych.59.103006.093548 [PubMed] [CrossRef] [Google Scholar] Koob G. F., Sanna P. P., Bloom F. E. (1998). Neuroscience of addiction. Neuron 21 467–476
- ^ Meyer, J. S., & Quenzer, L. F. (2013). Psychopharmacology: Drugs, the brain, and behavior. Sinauer Associates.
- ^ "Neuronal reward and decision signals: from theories to data". Physiological Reviews. 95 (3): 853-951. 2015. doi:10.1152/physrev.00023.2014. PMC 4491543 $2. PMID 26109341.
Rewards in operant conditioning are positive reinforcers. ... Operant behavior gives a good definition for rewards. Anything that makes an individual come back for more is a positive reinforcer and therefore a reward. Although it provides a good definition, positive reinforcement is only one of several reward functions. ... Rewards are attractive. They are motivating and make us exert an effort. ... Rewards induce approach behavior, also called appetitive or preparatory behavior, sexual behavior, and consummatory behavior. ... Thus any stimulus, object, event, activity, or situation that has the potential to make us approach and consume it is by definition a reward. ... Rewarding stimuli, objects, events, situations, and activities consist of several major components. First, rewards have basic sensory components (visual, auditory, somatosensory, gustatory, and olfactory) ... Second, rewards are salient and thus elicit attention, which are manifested as orienting responses (FIGURE 1, middle). The salience of rewards derives from three principal factors, namely, their physical intensity and impact (physical salience), their novelty and surprise (novelty/surprise salience), and their general motivational impact shared with punishers (motivational salience). A separate form not included in this scheme, incentive salience, primarily addresses dopamine function in addiction and refers only to approach behavior (as opposed to learning) ... Third, rewards have a value component that determines the positively motivating effects of rewards and is not contained in, nor explained by, the sensory and attentional components (FIGURE 1, right). This component reflects behavioral preferences and thus is subjective and only partially determined by physical parameters. Only this component constitutes what we understand as a reward. It mediates the specific behavioral reinforcing, approach generating, and emotional effects of rewards that are crucial for the organism’s survival and reproduction, whereas all other components are only supportive of these functions. ... Rewards can also be intrinsic to behavior (31, 546, 547). They contrast with extrinsic rewards that provide motivation for behavior and constitute the essence of operant behavior in laboratory tests. Intrinsic rewards are activities that are pleasurable on their own and are undertaken for their own sake, without being the means for getting extrinsic rewards. ... Intrinsic rewards are genuine rewards in their own right, as they induce learning, approach, and pleasure, like perfectioning, playing, and enjoying the piano. Although they can serve to condition higher order rewards, they are not conditioned, higher order rewards, as attaining their reward properties does not require pairing with an unconditioned reward. ... These emotions are also called liking (for pleasure) and wanting (for desire) in addiction research (471) and strongly support the learning and approach generating functions of reward.
- ^ Dayan (June 2014). "Model-based and model-free Pavlovian reward learning: revaluation, revision, and revelation". Cognitive, Affective, & Behavioral Neuroscience. 14 (2): 473-92. doi:10.3758/s13415-014-0277-8. PMC 4074442 $2. PMID 24647659.
- ^ Yin (October 2008). "Reward-guided learning beyond dopamine in the nucleus accumbens: the integrative functions of cortico-basal ganglia networks". The European Journal of Neuroscience. 28 (8): 1437-48. doi:10.1111/j.1460-9568.2008.06422.x. PMC 2756656 $2. PMID 18793321.
- ^ Balleine (2 Aralık 2015). "Thalamocortical integration of instrumental learning and performance and their disintegration in addiction". Brain Research. 1628 (Pt A): 104-16. doi:10.1016/j.brainres.2014.12.023. PMID 25514336.
Importantly, we found evidence of increased activity in the direct pathway; both intracellular changes in the expression of the plasticity marker pERK and AMPA/NMDA ratios evoked by stimulating cortical afferents were increased in the D1-direct pathway neurons. In contrast, D2 neurons showed an opposing change in plasticity; stimulation of cortical afferents reduced AMPA/NMDA ratios on those neurons (Shan et al., 2014).
- ^ Nakanishi (12 Aralık 2014). "Distinct dopaminergic control of the direct and indirect pathways in reward-based and avoidance learning behaviors". Neuroscience. 282: 49-59. doi:10.1016/j.neuroscience.2014.04.026. PMID 24769227.
- ^ Shiflett (15 Eylül 2011). "Molecular substrates of action control in cortico-striatal circuits". Progress in Neurobiology. 95 (1): 1-13. doi:10.1016/j.pneurobio.2011.05.007. PMC 3175490 $2. PMID 21704115.
- ^ Schultz (April 2013). "Updating dopamine reward signals". Current Opinion in Neurobiology. 23 (2): 229-38. doi:10.1016/j.conb.2012.11.012. PMC 3866681 $2. PMID 23267662.
- ^ Shiflett (17 Mart 2011). "Contributions of ERK signaling in the striatum to instrumental learning and performance". Behavioural Brain Research. 218 (1): 240-7. doi:10.1016/j.bbr.2010.12.010. PMC 3022085 $2. PMID 21147168.
- ^ Kaynak hatası: Geçersiz
<ref>etiketi;What the ΔFosB?isimli refler için metin sağlanmadı (Bkz: Kaynak gösterme) - ^ a b Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109-1122. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704 $2. PMID 21459101.
Functional neuroimaging studies in humans have shown that gambling (Breiter et al, 2001), shopping (Knutson et al, 2007), orgasm (Komisaruk et al, 2004), playing video games (Koepp et al, 1998; Hoeft et al, 2008) and the sight of appetizing food (Wang et al, 2004a) activate many of the same brain regions (i.e., the mesocorticolimbic system and extended amygdala) as drugs of abuse (Volkow et al, 2004). ... Cross-sensitization is also bidirectional, as a history of amphetamine administration facilitates sexual behavior and enhances the associated increase in NAc DA ... As described for food reward, sexual experience can also lead to activation of plasticity-related signaling cascades. The transcription factor delta FosB is increased in the NAc, PFC, dorsal striatum, and VTA following repeated sexual behavior (Wallace et al., 2008; Pitchers et al., 2010b). This natural increase in delta FosB or viral overexpression of delta FosB within the NAc modulates sexual performance, and NAc blockade of delta FosB attenuates this behavior (Hedges et al, 2009; Pitchers et al., 2010b). Further, viral overexpression of delta FosB enhances the conditioned place preference for an environment paired with sexual experience (Hedges et al., 2009). ... In some people, there is a transition from "normal" to compulsive engagement in natural rewards (such as food or sex), a condition that some have termed behavioral or non-drug addictions (Holden, 2001; Grant et al., 2006a). ... In humans, the role of dopamine signaling in incentive-sensitization processes has recently been highlighted by the observation of a dopamine dysregulation syndrome in some patients taking dopaminergic drugs. This syndrome is characterized by a medication-induced increase in (or compulsive) engagement in non-drug rewards such as gambling, shopping, or sex (Evans et al, 2006; Aiken, 2007; Lader, 2008)."
Table 1: Summary of plasticity observed following exposure to drug or natural reinforcers 9 Ağustos 2021 tarihinde Wayback Machine sitesinde arşivlendi." - ^ a b "Epigenetic regulation in drug addiction". Ann. Agric. Environ. Med. 19 (3): 491-496. 2012. PMID 23020045.
For these reasons, ΔFosB is considered a primary and causative transcription factor in creating new neural connections in the reward centre, prefrontal cortex, and other regions of the limbic system. This is reflected in the increased, stable and long-lasting level of sensitivity to cocaine and other drugs, and tendency to relapse even after long periods of abstinence. These newly constructed networks function very efficiently via new pathways as soon as drugs of abuse are further taken ... In this way, the induction of CDK5 gene expression occurs together with suppression of the G9A gene coding for dimethyltransferase acting on the histone H3. A feedback mechanism can be observed in the regulation of these 2 crucial factors that determine the adaptive epigenetic response to cocaine. This depends on ΔFosB inhibiting G9a gene expression, i.e. H3K9me2 synthesis which in turn inhibits transcription factors for ΔFosB. For this reason, the observed hyper-expression of G9a, which ensures high levels of the dimethylated form of histone H3, eliminates the neuronal structural and plasticity effects caused by cocaine by means of this feedback which blocks ΔFosB transcription
- ^ "Natural and drug rewards act on common neural plasticity mechanisms with ΔFosB as a key mediator". The Journal of Neuroscience. 33 (8): 3434-3442. February 2013. doi:10.1523/JNEUROSCI.4881-12.2013. PMC 3865508 $2. PMID 23426671.
Drugs of abuse induce neuroplasticity in the natural reward pathway, specifically the nucleus accumbens (NAc), thereby causing development and expression of addictive behavior. ... Together, these findings demonstrate that drugs of abuse and natural reward behaviors act on common molecular and cellular mechanisms of plasticity that control vulnerability to drug addiction, and that this increased vulnerability is mediated by ΔFosB and its downstream transcriptional targets. ... Sexual behavior is highly rewarding (Tenk et al., 2009), and sexual experience causes sensitized drug-related behaviors, including cross-sensitization to amphetamine (Amph)-induced locomotor activity (Bradley and Meisel, 2001; Pitchers et al., 2010a) and enhanced Amph reward (Pitchers et al., 2010a). Moreover, sexual experience induces neural plasticity in the NAc similar to that induced by psychostimulant exposure, including increased dendritic spine density (Meisel and Mullins, 2006; Pitchers et al., 2010a), altered glutamate receptor trafficking, and decreased synaptic strength in prefrontal cortex-responding NAc shell neurons (Pitchers et al., 2012). Finally, periods of abstinence from sexual experience were found to be critical for enhanced Amph reward, NAc spinogenesis (Pitchers et al., 2010a), and glutamate receptor trafficking (Pitchers et al., 2012). These findings suggest that natural and drug reward experiences share common mechanisms of neural plasticity
- ^ "Nucleus accumbens NMDA receptor activation regulates amphetamine cross-sensitization and deltaFosB expression following sexual experience in male rats". Neuropharmacology. 101: 154-164. February 2016. doi:10.1016/j.neuropharm.2015.09.023. PMID 26391065.
- ^ "Transcriptional and epigenetic mechanisms of addiction". Nat. Rev. Neurosci. 12 (11): 623-637. November 2011. doi:10.1038/nrn3111. PMC 3272277 $2. PMID 21989194.
ΔFosB serves as one of the master control proteins governing this structural plasticity. ... ΔFosB also represses G9a expression, leading to reduced repressive histone methylation at the cdk5 gene. The net result is gene activation and increased CDK5 expression. ... In contrast, ΔFosB binds to the c-fos gene and recruits several co-repressors, including HDAC1 (histone deacetylase 1) and SIRT 1 (sirtuin 1). ... The net result is c-fos gene repression.
Figure 4: Epigenetic basis of drug regulation of gene expression 8 Mart 2021 tarihinde Wayback Machine sitesinde arşivlendi. - ^ "Histone-mediated epigenetics in addiction". Epigenetics and Neuroplasticity—Evidence and Debate. Prog Mol Biol Transl Sci. Progress in Molecular Biology and Translational Science. 128. 2014. ss. 51-87. doi:10.1016/B978-0-12-800977-2.00003-6. ISBN 9780128009772. PMC 5914502 $2. PMID 25410541.
- ^ "Neuroepigenetics and addiction". Neurogenetics, Part II. Handbook of Clinical Neurology. 148. 2018. ss. 747-765. doi:10.1016/B978-0-444-64076-5.00048-X. ISBN 9780444640765. PMC 5868351 $2. PMID 29478612.
- ^ Molecular Neuropharmacology: A Foundation for Clinical Neuroscience. 2nd. New York: McGraw-Hill Medical. 2009. ss. 365-366, 376. ISBN 978-0-07-148127-4.
The neural substrates that underlie the perception of reward and the phenomenon of positive reinforcement are a set of interconnected forebrain structures called brain reward pathways; these include the nucleus accumbens (NAc; the major component of the ventral striatum), the basal forebrain (components of which have been termed the extended amygdala, as discussed later in this chapter), hippocampus, hypothalamus, and frontal regions of cerebral cortex. These structures receive rich dopaminergic innervation from the ventral tegmental area (VTA) of the midbrain. Addictive drugs are rewarding and reinforcing because they act in brain reward pathways to enhance either dopamine release or the effects of dopamine in the NAc or related structures, or because they produce effects similar to dopamine. ... A macrostructure postulated to integrate many of the functions of this circuit is described by some investigators as the extended amygdala. The extended amygdala is said to comprise several basal forebrain structures that share similar morphology, immunocytochemical features, and connectivity and that are well suited to mediating aspects of reward function; these include the bed nucleus of the stria terminalis, the central medial amygdala, the shell of the NAc, and the sublenticular substantia innominata.
- ^ Pharmacology. Edinburgh: Churchill Livingstone. 2003. s. 596. ISBN 978-0-443-07145-4.
- ^ a b Roy A. Wise, Drug-activation of brain reward pathways, Drug and Alcohol Dependence 1998; 51 13–22.
- ^ Goeders N.E., Smith J.E. (1983). "Cortical dopaminergic involvement in cocaine reinforcement". Science. 221 (4612): 773-775. doi:10.1126/science.6879176. PMID 6879176.
- ^ Goeders N.E., Smith J.E. (1993). "Intracranial cocaine self-administration into the medial prefrontal cortex increases dopamine turnover in the nucleus accumbens". J. Pharmacol. Exp. Ther. 265 (2): 592-600. PMID 8496810.
- ^ Clarke, Hommer D.W. (1985). "Electrophysiological actions of nicotine on substantia nigra single units". Br. J. Pharmacol. 85 (4): 827-835. doi:10.1111/j.1476-5381.1985.tb11081.x. PMC 1916681 $2. PMID 4041681.
- ^ Westfall (January 1983). "Release of dopamine and 5-hydroxytryptamine from rat striatal slices following activation of nicotinic cholinergic receptors". General Pharmacology: The Vascular System. 14 (3): 321-325. doi:10.1016/0306-3623(83)90037-x. PMID 6135645.
- ^ Rømer Thomsen (2015). "Reconceptualizing anhedonia: novel perspectives on balancing the pleasure networks in the human brain". Frontiers in Behavioral Neuroscience. 9: 49. doi:10.3389/fnbeh.2015.00049. PMC 4356228 $2. PMID 25814941.
- ^ Thomsen (2015). "Measuring anhedonia: impaired ability to pursue, experience, and learn about reward". Frontiers in Psychology. 6: 1409. doi:10.3389/fpsyg.2015.01409. PMC 4585007 $2. PMID 26441781.
- ^ Olney (August 2018). "Current perspectives on incentive salience and applications to clinical disorders". Current Opinion in Behavioral Sciences. 22: 59-69. doi:10.1016/j.cobeha.2018.01.007. PMC 5831552 $2. PMID 29503841.
- ^ "Brain Imaging Correlates of Anhedonia". Anhedonia : a comprehensive handbook. Dordrecht: Springer Netherlands. 2014. ISBN 978-94-017-8590-7.
- ^ Zhang (September 2016). "Mapping anhedonia-specific dysfunction in a transdiagnostic approach: an ALE meta-analysis". Brain Imaging and Behavior. 10 (3): 920-39. doi:10.1007/s11682-015-9457-6. PMC 4838562 $2. PMID 26487590.
- ^ Balsam, Peter D., (Ed.) (2016). "The Neurobiology of Motivational Deficits in Depression— An Update on Candidate Pathomechanisms". Behavioral Neuroscience of Motivation (Current Topics in Behavioral Neurosciences). 1st. Switzerland: Springer International Publishing. s. 343. ISBN 978-3-319-26933-7.
In a relatively recent literature, studies of motivation and reinforcement in depression have been largely consistent in detecting differences as compared to healthy controls (Whitton et al. 2015). In several studies using the effort expenditure for reward task (EEfRT), patients with MDD expended less effort for rewards when compared with controls (Treadway et al. 2012; Yang et al. 2014)
r eksik|soyadı1=(yardım) - ^ Salamone (May 2016). "Activational and effort-related aspects of motivation: neural mechanisms and implications for psychopathology". Brain: A Journal of Neurology. 139 (Pt 5): 1325-47. doi:10.1093/brain/aww050. PMC 5839596 $2. PMID 27189581.
- ^ Russo (September 2013). "The brain reward circuitry in mood disorders". Nature Reviews. Neuroscience. 14 (9): 609-25. doi:10.1038/nrn3381. PMC 3867253 $2. PMID 23942470.
- ^ Treadway (January 2011). "Reconsidering anhedonia in depression: lessons from translational neuroscience". Neuroscience and Biobehavioral Reviews. 35 (3): 537-55. doi:10.1016/j.neubiorev.2010.06.006. PMC 3005986 $2. PMID 20603146.
- ^ Walsh (12 Aralık 2014). "The heterogeneity of ventral tegmental area neurons: Projection functions in a mood-related context". Neuroscience. 282: 101-8. doi:10.1016/j.neuroscience.2014.06.006. PMC 4339667 $2. PMID 24931766.
- ^ Knowland (5 Ocak 2018). "Circuit-based frameworks of depressive behaviors: The role of reward circuitry and beyond". Pharmacology Biochemistry and Behavior. 174: 42-52. doi:10.1016/j.pbb.2017.12.010. PMC 6340396 $2. PMID 29309799.
- ^ a b Lammel (January 2014). "Progress in understanding mood disorders: optogenetic dissection of neural circuits". Genes, Brain, and Behavior. 13 (1): 38-51. doi:10.1111/gbb.12049. PMID 23682971.
- ^ Bucci (May 2017). "Categorizing and assessing negative symptoms". Current Opinion in Psychiatry. 30 (3): 201-208. doi:10.1097/YCO.0000000000000322. PMID 28212174.
They also provide a separate assessment of the consummatory anhedonia (reduced experience of pleasure derived from ongoing enjoyable activities) and anticipatory anhedonia (reduced ability to anticipate future pleasure). In fact, the former one seems to be relatively intact in schizophrenia, whereas the latter one seems to be impaired [32 – 34]. However, discrepant data have also been reported [35].
- ^ a b c Young, Anticevic & Barch 2018.
- ^ "Never Enough? Why ADHD Brains Crave Stimulation". ADDditude Magazine. New Hope Media LLC. 21 Mart 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Mayıs 2021.
- ^ "New perspectives on catecholaminergic regulation of executive circuits: evidence for independent modulation of prefrontal functions by midbrain dopaminergic and noradrenergic neurons". Frontiers in Neural Circuits. 8: 53. May 2014. doi:10.3389/fncir.2014.00053. PMC 4033238 $2. PMID 24904299.
- ^ Blum (October 2008). "Attention-deficit-hyperactivity disorder and reward deficiency syndrome". Neuropsychiatric Disease and Treatment. 4 (5): 893-918. doi:10.2147/ndt.s2627. ISSN 1176-6328. PMC 2626918 $2. PMID 19183781.
- ^ "Addictive drugs and brain stimulation reward". Annu. Rev. Neurosci. 19: 319-340. 1996. doi:10.1146/annurev.ne.19.030196.001535. PMID 8833446.
- ^ a b "human nervous system | Description, Development, Anatomy, & Function". Encyclopedia Britannica. 16 Haziran 2015 tarihinde kaynağından arşivlendi.
- ^ a b James Olds and Peter Milner (Dec 1954). "Positive reinforcement produced by electrical stimulation of the septal area and other regions of rat brain". Journal of Comparative and Physiological Psychology. 47 (6): 419–427. doi:10.1037/h0058775. PMID 13233369. 2 Temmuz 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2021.
- ^ Kringelbach (25 Haziran 2010). "The Functional Neuroanatomy of Pleasure and Happiness". Discovery Medicine. 9 (49): 579-587. PMC 3008353 $2. PMID 20587348. 3 Eylül 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2021 – www.discoverymedicine.com vasıtasıyla.
- ^ Conditioned Reflexes. Courier Corporation. 2003. ss. 1-. ISBN 978-0-486-43093-5. 17 Aralık 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Eylül 2021.
- ^ Fridlund, Alan and James Kalat. Mind and Brain, the Science of Psychology. California: Cengage Learning, 2014. Print.
- ^ a b Berridge (August 2008). "Affective neuroscience of pleasure: reward in humans and animals". Psychopharmacology. 199 (3): 457-480. doi:10.1007/s00213-008-1099-6. PMC 3004012 $2. PMID 18311558.
- ^ a b "Dopamine modulates the reward experiences elicited by music". Proceedings of the National Academy of Sciences of the United States of America. 116 (9): 3793-3798. January 2019. doi:10.1073/pnas.1811878116. PMC 6397525 $2. PMID 30670642. Diğer özet – Neuroscience News (24 Ocak 2019).
Listening to pleasurable music is often accompanied by measurable bodily reactions such as goose bumps or shivers down the spine, commonly called “chills” or “frissons.” ... Overall, our results straightforwardly revealed that pharmacological interventions bidirectionally modulated the reward responses elicited by music. In particular, we found that risperidone impaired participants’ ability to experience musical pleasure, whereas levodopa enhanced it. ... Here, in contrast, studying responses to abstract rewards in human subjects, we show that manipulation of dopaminergic transmission affects both the pleasure (i.e., amount of time reporting chills and emotional arousal measured by EDA) and the motivational components of musical reward (money willing to spend). These findings suggest that dopaminergic signaling is a sine qua non condition not only for motivational responses, as has been shown with primary and secondary rewards, but also for hedonic reactions to music. This result supports recent findings showing that dopamine also mediates the perceived pleasantness attained by other types of abstract rewards (37) and challenges previous findings in animal models on primary rewards, such as food (42, 43).
- ^ a b "Musical pleasure and musical emotions". Proceedings of the National Academy of Sciences of the United States of America. 116 (9): 3364-3366. February 2019. doi:10.1073/pnas.1900369116. PMC 6397567 $2. PMID 30770455.
In a pharmacological study published in PNAS, Ferreri et al. (1) present evidence that enhancing or inhibiting dopamine signaling using levodopa or risperidone modulates the pleasure experienced while listening to music. ... In a final salvo to establish not only the correlational but also the causal implication of dopamine in musical pleasure, the authors have turned to directly manipulating dopaminergic signaling in the striatum, first by applying excitatory and inhibitory transcranial magnetic stimulation over their participants’ left dorsolateral prefrontal cortex, a region known to modulate striatal function (5), and finally, in the current study, by administrating pharmaceutical agents able to alter dopamine synaptic availability (1), both of which influenced perceived pleasure, physiological measures of arousal, and the monetary value assigned to music in the predicted direction. ... While the question of the musical expression of emotion has a long history of investigation, including in PNAS (6), and the 1990s psychophysiological strand of research had already established that musical pleasure could activate the autonomic nervous system (7), the authors’ demonstration of the implication of the reward system in musical emotions was taken as inaugural proof that these were veridical emotions whose study has full legitimacy to inform the neurobiology of our everyday cognitive, social, and affective functions (8). Incidentally, this line of work, culminating in the article by Ferreri et al. (1), has plausibly done more to attract research funding for the field of music sciences than any other in this community. The evidence of Ferreri et al. (1) provides the latest support for a compelling neurobiological model in which musical pleasure arises from the interaction of ancient reward/valuation systems (striatal–limbic–paralimbic) with more phylogenetically advanced perception/predictions systems (temporofrontal).
